Cu o mortalitate și o rată de recidivă ridicate, glioblastomul cerebral multiform (GM) reprezintă o provocare pentru lumea medicală, cercetările noi urmărind identificarea de noi direcţii pentru îmbunătăţirea prognosticului și a supravieţuirii.
Tumorile cerebrale reprezintă mai puţin de 2% din toate neoplasmele primare diagnosticate. Rata mare de mortalitate le plasează pe locul al treilea între cauzele de mortalitate neoplazică în grupul pacienţilor de sex masculin cu vârsta cuprinsă între 15 și 45 de ani și pe locul al patrulea în grupul pacienţilor de sex feminin cu vârsta cuprinsă între 15 și 34 ani (1). Referitor la numărul de ani de viaţă pierduţi, tumorile cerebrale sunt răspunzătoare pentru cel mai mare index PYLL (potential years of life lost) asociat neoplasmelor, cu peste 20 de ani pierduţi/pacient. Cele mai frecvente tumori primare ale adultului sunt astrocitoamele, iar dintre acestea, cea mai mare frecvenţă de apariţie o are glioblastomul multiform.
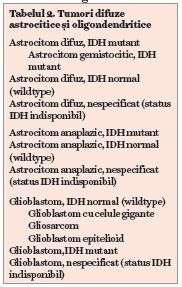
Glioblastomul multiform este o tumoră cu origine neuroectodermală și reprezintă cea mai frecventă și, totodată, „cea mai malignă” tumoră glială. Este inclusă în clasificarea OMS în cadrul tumorilor neuroectodermale primare, iar în clasificarea anterioară, încă frecvent utilizată în practică, în cadrul astrocitoamelor, reprezentând gradul IV de astrocitoame (tab. 1 și 2).

Reprezintă 50-60% dintre tumorile astrocitoame și aproximativ 12-20% dintre neoplasmele intracraniene. În majoritatea statelor din Europa și America de Nord, incidenţa anuală ajunge la 2-4 cazuri noi la 100.000 locuitori pe an. GM poate fi diagnosticat la orice vârstă, însă afectează în mod preferenţial adulţii, cu un vârf de incidenţă între 45 și 70 de ani. Diagnosticul se stabilește cel mai frecvent la o vârstă medie de 53 de ani, doar 8,8% dintre cazuri apărând la copii (2).
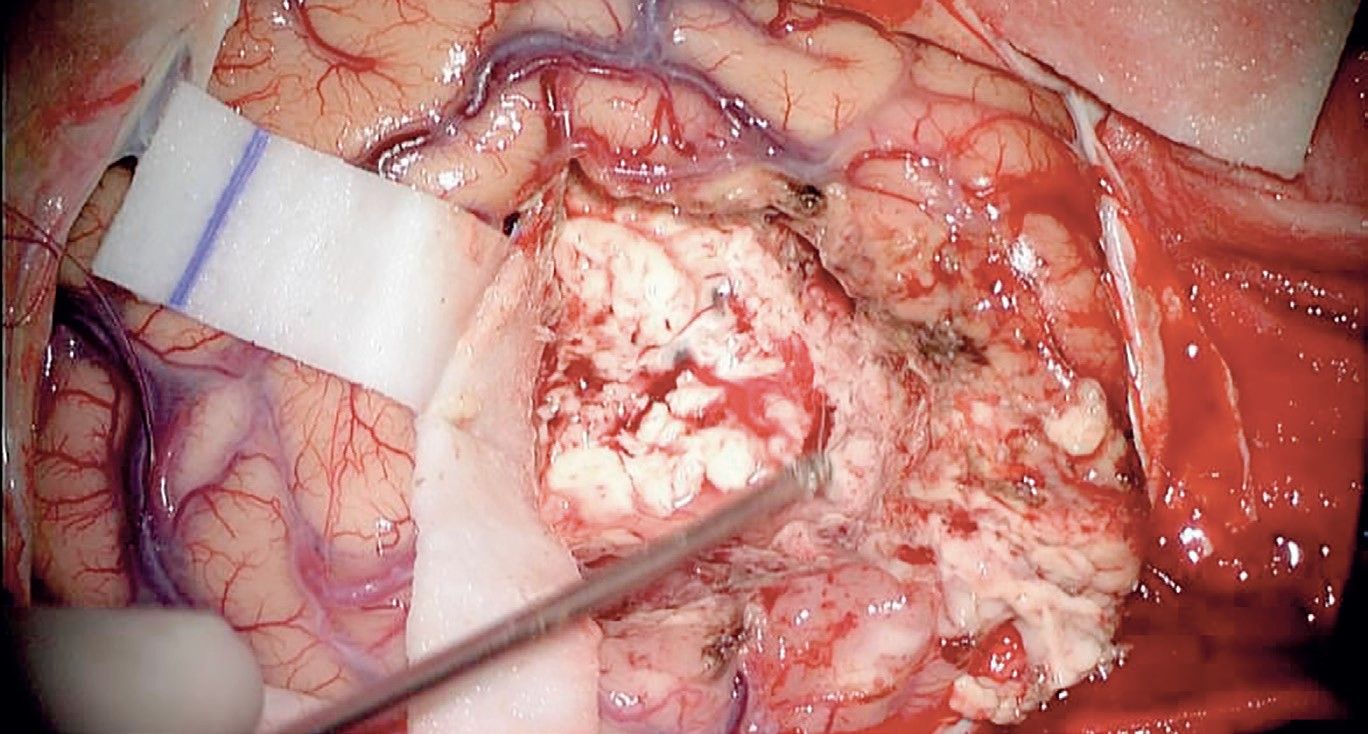
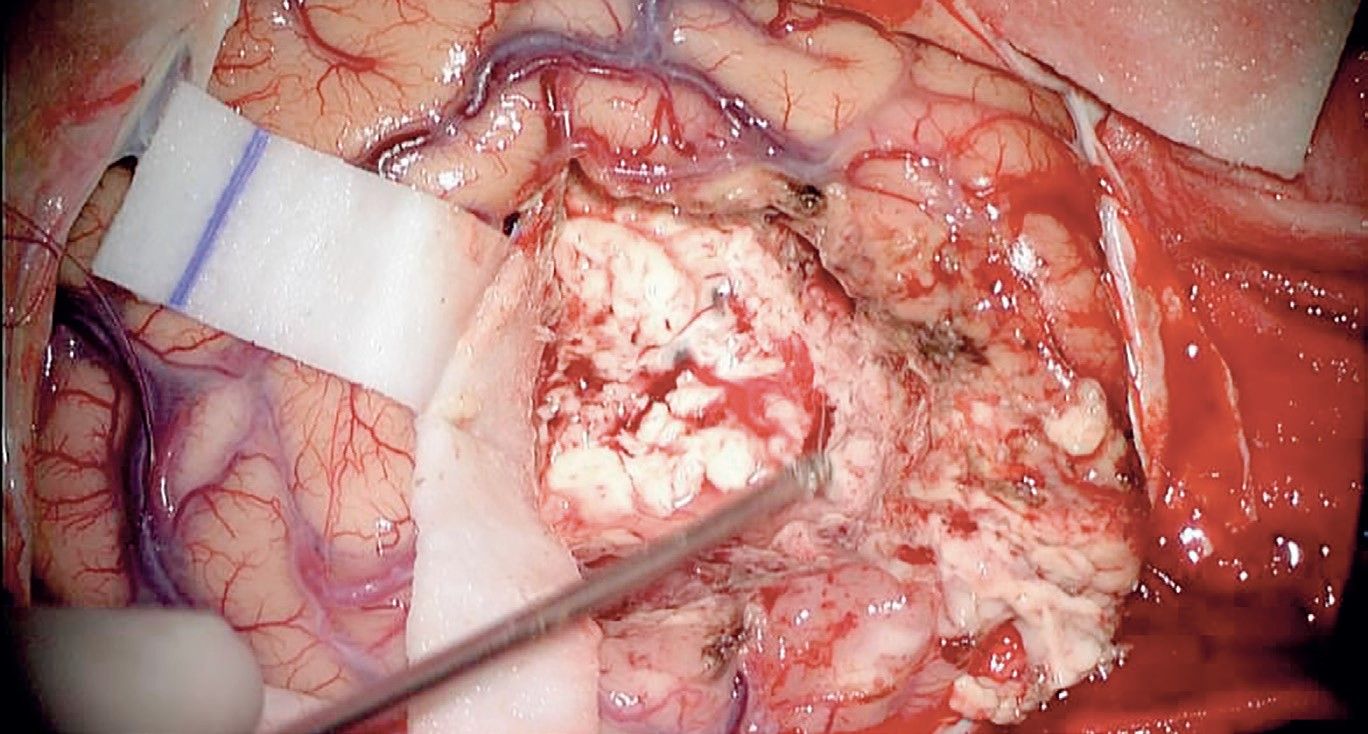
Glioblastomul este o tumoră cerebrală extrem de rezistentă la posibilităţile terapeutice actuale, câștigându-și denumirea de multiform ca urmare a caracteristicilor sale macroscopice, microscopice și genetice, toate ducând la agresivitate și rezistenţă terapeutică pronunţate. Macroscopic, glioblastomul se prezintă ca o tumoră difuză din punct de vedere topografic, incluzând în structura sa arii de necroză și hemoragie (fig. 1).
Microscopic, se pot decela regiuni de necroză în pseudopalisadă, nuclei și celule pleomorfice, dar și proliferarea microvascularizaţiei (3).
Din punct de vedere genetic, glioblastomul prezintă o înaltă heterogenitate intratumorală, estimată la 1 din 1.000 de celule, multiple deleţii, amplificări sau mutaţii punctiforme. Expresia genei IDH1 sugerează activitatea enzimatică neomorfică, catalizând producerea de oncometabolite ce influenţează o gamă largă de programe celulare care afectează epigenomul și contribuie la dezvoltarea glioblastomului.
Localizarea preferenţială a acestei tumori este la nivelul emisferelor cerebrale, fiind descrisă ca o masă neregulată la nivelul substanţei albe, ce reflectă parenchimul adiacent, trecând frecvent de linia mediană, prin afectarea corpului calos. Extrem de rar se întâlnește la nivelul trunchiului cerebral sau la nivelul măduvei spinării.
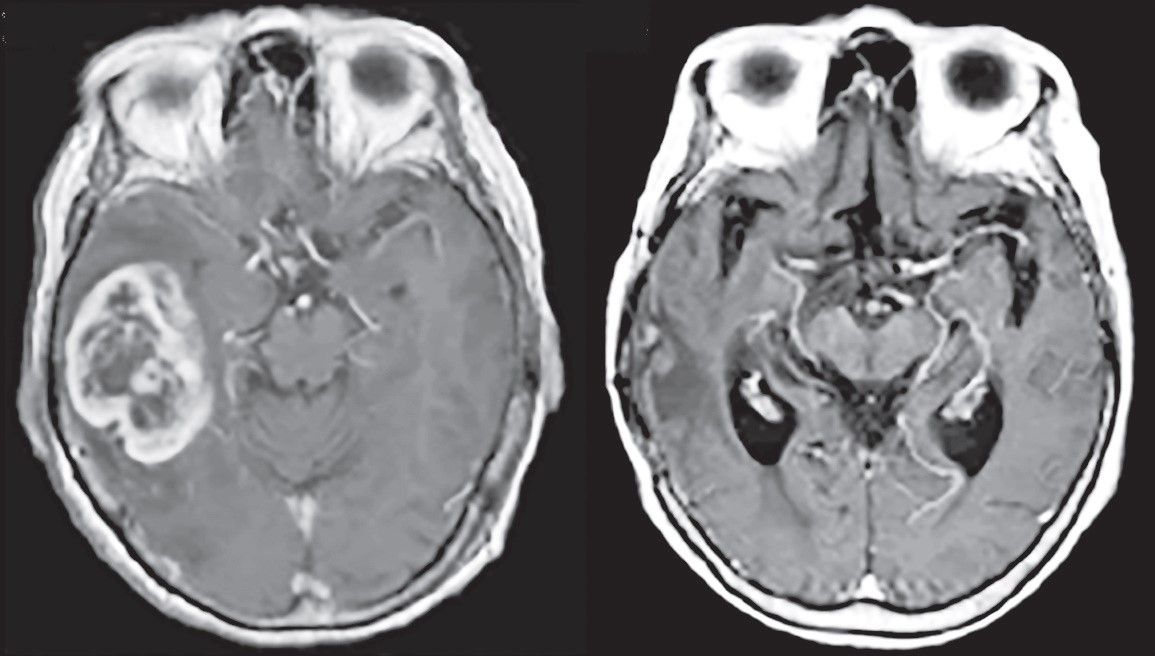
Neuroimagistica este esenţială pentru diagnosticarea GM. Pe imaginile de CT, glioblastomul apare de obicei ca o leziune hipodensă, neregulată, cu o zonă periferică inelară ce captează contrastul și cu edem cerebral în penumbră. Imagistica prin rezonanţă magnetică (IRM) cu și fără substanţă de contrast și, în special, spectroscopia prin rezonanţă magnetică reprezintă standardul de aur în diagnosticarea glioblastomului (fig. 2).
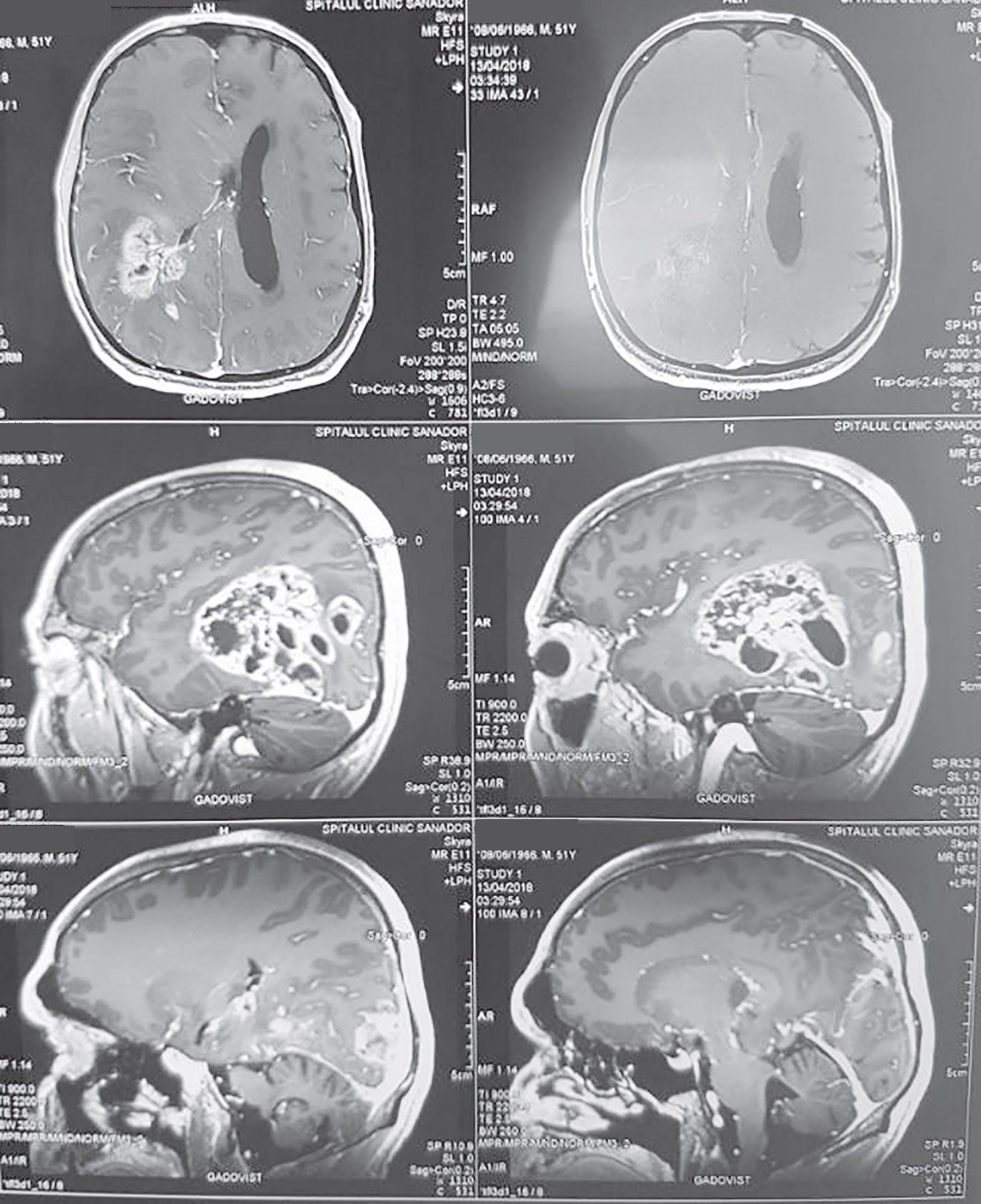
Spectroscopia IRM reprezintă standardul curent pentru investigarea pacienţilor cu gliom de grad înalt, aducând informaţii despre statusul metabolic al tumorii și al encefalului. Aceasta poate diferenţia între radionecroză localizată și recidivă tumorală, datorită creșterii nivelului de colină postbrahiterapie, în cazul unei recidive (5).
Tratamentul pacienţilor diagnosticaţi cu glioblastom implică formarea unei echipe multidisciplinare, ce include specialiști în neurochirurgie, neuro-oncologie, neuroradiologie, psihologie/psihiatrie, dar și asistente medicale dedicate și asistenţi sociali. Tratamentul glioblastomului este complex, multimodal, aplicat pentru încercarea stopării evoluţiei tumorale, prelungirea supravieţuirii și asigurarea unei calităţi a vieţii acceptabile. Tratamentul acestei patologii este extrem de dificil, ţinând cont de rezistenţa celulelor tumorale la chimioterapie sau la alte terapii convenţionale și de susceptibilitatea ţesutului cerebral de a fi afectat în cursul tratamentului, cu o capacitate limitată de regenerare. Tratamentul standard actual este cel chirurgical, fiind urmat întotdeauna de radioterapie fracţională externă sau de brahiterapie și chimioterapie. Tratamentul actual constă în intervenţia de exereză neurochirurgicală a tumorii sau biopsie stereotaxică, urmată de radioterapie cu o doză totală de până la 60 Gy și administrare de chimioterapie, de primă intenţie fiind temozolomida (fig. 3 ) (6).
Chiar și prin administrarea unui tratament optim, riscul recidivei tumorale în cazul GM rămâne foarte mare. Aproape toţi pacienţii trataţi pentru glioblastom primar dezvoltă o recidivă tumorală, iar supravieţuirea medie după recurenţă se încadrează între 3 și 6 luni. Tumora reapare de obicei în același loc sau aproape de sediul tumorii primare. Opţiunile terapeutice în cazul recurenţei tumorale sunt aceleași ca în cazul glioblastomului primar și cuprind: microchirurgie, chimioterapie, inhibitori ai angiogenezei, radioterapie, brahiterapie sau radiochimioterapie.
Prognosticul pacienţilor diagnosticaţi cu glioblastom depinde de o varietate de factori, incluzând: localizarea tumorală (definește caracterul operabil sau inoperabil al tumorii), extensia rezecţiei tumorale, dimensiunile ariei de necroză descrise în studiile IRM, vârsta pacientului, statusul de performanţă la internare – extensia deteriorării neurologice și funcţionale. De asemenea, metilarea MGMT (metil guanedin metil transferaza) reprezintă un factor prognostic independent pentru eficienţa tratamentului, care combină temozolomidă și radioterapie, la toate grupele de vârstă. Prin intermediul testelor genetice se poate determina prezenţa sau absenţa metilării promotorului genei MGMT, prezenţa acesteia fiind asociată cu un beneficiu semnificativ pe termen lung în ceea ce privește supravieţuirea (7, 8).
Abordările actuale în studiul tratamentului glioblastomului, cum sunt terapia genică și imunoterapia, precum și metodele îmbunătăţite de administrare a terapiilor antiproliferative, antiangiogenice și noninvazive, reprezintă direcţii promiţătoare în asigurarea unui prognostic favorabil și a unei supravieţuiri de lungă durată. Genotiparea glioblastomului poate oferi o abordare inovatoare a stratificării prognosticului pacienţilor. Rezecţia radicală iniţială şi repetarea procedurii chirurgicale în cazul recidivelor influenţează favorabil perioada de supravieţuire. Formarea unei echipe multidisciplinare (neurochirurgie, neuro-oncologie, neuroradiologie) este un factor extrem de important în asigurarea unui tratament optim şi în monitorizarea evoluţiei pacientului.
Lista agenţilor terapeutici noi cu rezultate bune în tratamentul glioblastomului continuă să se extindă, fiind necesară încurajarea integrării a cât mai multor pacienţi în noi studii clinice. Pentru viitor, necesită studii clinice avansate noile terapii ţintite la nivel molecular în tratamentul glioblastomului, cu rezultate iniţiale promiţătoare: inhibitorii EGFR tirozin kinazei (Erlotinib); inhibitorii angiogenezei (Bevacizumab, Cediranib, Cilengitid, Aflibercept); inhibitorii mTOR (Sirolimus, temsirolimus, Everolimus) (9-11).
1. Ostrom Q.T., Gittleman H., Xu J., Kromer C., Wolinsky Y., Kruchko C, Barnholtz-Sloan J. S.; CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2009-2013, Neuro-Oncology, Volume 18, Issue suppl_5, 1 2016 Oct; 1-75
2. Gliomas and Malignant Astrocyromas - American Brain Tumor Association 2016
3. Wippold FJ 2nd, Lämmle M., Anatelli F., Lennerz J., Perry A. Neuropathology for the neuroradiologist: palisades and pseudopalisades. AJNR Am J Neuroradiol. 2006 Nov-Dec; 27
4. Wahl D.R., Dresser J., Wilder-Romans K., Parsels J.D., Zhao S.G., Davis M., Zhao L., Kachman M., Wernisch S., Burant C.F., Morgan M.A., Feng F.Y., Speers C., Lyssiotis C.A., Lawrence T.S. Glioblastoma Therapy Can Be Augmented by Targeting IDH1-Mediated NADPH Biosynthesis. Cancer Res. 2017 Feb 15; 77(4)
5. Ryu S., Buatti J.M., Morris A., Kalkanis S.N., Ryken T.C., Olson J.J.; AANS/CNS Joint Guidelines Committee. The role of radiotherapy in the management of progressive glioblastoma: a systematic review and evidence-based clinical practice guideline. J Neurooncol. 2014 Jul;.118(3):.489-99
6. Stupp R., Mason W.P., van den Bent M.J., Weller M., Fisher B., Taphoorn M.J., Belanger K., Brandes A.A., Marosi C., Bogdahn U., Curschmann J., Janzer R.C., Ludwin S.K., Gorlia T., Allgeier A., Lacombe D., Cairncross J.G., Eisenhauer E., Mirimanoff R.O., European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups, Național Cancer Institute of Canada Clinical Trials Group Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 352: 987-96, 2005
7. Ohagaki H., Kleihues P. Population- based studies on incidence, suvival rates, and genetic alterations in astrocytic and oligodendroglial gliomas. J Neuropathol Exp Neurol. Jun 2015; 64(6):.479-89
8. Martinez R., Schackert G., Yaya-Tur R. Frequent hypermethilation of the DNA repair gene MGMT in long-term survivors of glioblastoma multiforme. Journal of Neuro-Oncology. 2007; 83(1): 91-93
9. Jackson C., Ruzevick J., Brem H., Lim M. Vaccine strategies for glioblastoma: progress and future directions. Immunotherapy. 2013; 5(2): 155-67
10. Mohme M., Neidert M.C., Regli L., Weller M., Martin R. Immunological challenges for peptide-based immunotherapy in glioblastoma. Cancer treatment reviews. 2014; 40(2): 248-58
11. Nazamizo A., Marini F., Amano T.: Human bone marrow derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 2015; 65: 3307-18
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe