Biopsia tumorală lichidă are o serie de avantaje și poate completa varianta clasică de biopsiere.
 Este bine cunoscută necesitatea prelevării unui fragment de ţesut tumoral pentru precizarea în laborator a diagnosticului de cancer. Deși biopsia tumorală „clasică”, denumită și biopsie tumorală solidă (BTS), continuă să fie procedura standard utilizată în diagnosticul oncologic, urmată de examinare imunohistopatologică și genomică, ea are câteva limitări.
Este bine cunoscută necesitatea prelevării unui fragment de ţesut tumoral pentru precizarea în laborator a diagnosticului de cancer. Deși biopsia tumorală „clasică”, denumită și biopsie tumorală solidă (BTS), continuă să fie procedura standard utilizată în diagnosticul oncologic, urmată de examinare imunohistopatologică și genomică, ea are câteva limitări.
Manevrele de prelevare, deși au devenit acte medicale de rutină, nu sunt lipsite de potenţiale incidente și de complicaţii (hemoragice, infecţioase, lezarea unor ţesuturi de vecinătate ș.a.) și induc un disconfort pentru pacient atât psihologic, cât și fizic, de unde și dificultatea/imposibilitatea repetării ei pe parcursul evoluţiei bolii canceroase.
În plus, biopsia tumorală tisulară furnizează doar datele de început ale procesului oncologic la un pacient anume. Acest proces este însă unul dinamic, grevat de dezvoltarea de subclone (subpopulaţii) de celule tumorale, cu diverse avantaje de proliferare și rezistente la diferite tratamente administrate pe parcursul bolii.
Mai mult, există o „heterogenitate tumorală spaţială” a modificărilor genetice, constând din diferenţe între sediile anatomice ale tumorii și chiar între arii ale aceluiași sediu, atât la diagnosticare, cât și, mai ales, în stadiile mai avansate ale bolii.
Însă ţesutul tumoral eliberează în sângele circulant și în alte fluide ale organismului celule tumorale întregi sau, mai ales, produși acelulari rezultaţi prin dezintegrarea acestora prin necroză sau apoptoză spontană ori chimioterapic-indusă.
Produșii acelulari rezultaţi prin dezintegrarea celulelor tumorale constau din fragmente libere de ADN (ADN tumoral circulant, ADNtc) și din exosomi, vezicule ce conţin proteine și acizi nucleici de tip atât ARN (mesager, microzomal), cât și ADN.
ADNtc aparţine în fapt unui compartiment mult mai amplu din plasmă numit ADN acelular (ADNac) și provenit în principal din celulele sanguine. În ultimii ani se remarcă un interes în creștere pentru investigarea acestui fenomen, interes susţinut atât de cercetători, cu peste 220 de trialuri cu acest subiect în lume și 539 de articole publicate doar în perioada 2015-2020, cât și de practicieni și pacienţi.
Identificarea și analiza acestor compuși au fost reunite sub termenul de biopsie tumorală lichidă (BTL), termen introdus în limbajul medical de circa 12 ani. El definește actul medical ce presupune obţinerea acelorași date genetice ca acelea furnizate de biopsia tisulară, dar prin prelevarea doar a unui eșantion de sânge periferic sau din alt biofluid.
BTL permite, după examinarea în laborator a materialului, obţinerea informaţiilor circulante despre tumoră de ordin genomic, epigenetic, transcriptomic și proteomic („circulomul tumoral”).
Faţă de BTS, BTL este mai facilă, mai rapidă, minim invazivă și astfel ușor de repetat, oferă informaţii în timp real și are costuri mai reduse. Aceste caracteristici conferă potenţialul de a fi utilizată pentru efectuarea triajului și stabilirii diagnosticului mai timpuriu al bolii, pentru evaluarea prognosticului și a răspunsului la tratament, monitorizarea evoluţiei.
Cum anume? Prin cuantificarea periodică a nivelului ADNtc, prin detectarea evoluţiei clonale și a clonelor rezistente, în vederea reorientării tratamentului și identificării pacienţilor eligibili pentru anumite tratamente ţintite.
Deși cercetarea în domeniul neoplaziilor maligne hematologice („tumori lichide”) este avantajată faţă de cea din domeniul tumorilor solide prin accesibilitatea și disponibilitatea mai mari ale materialului de studiu, datele acumulate privind BTL sunt mult mai numeroase în domeniul tumorilor solide. Totuși, interesul pentru aplicarea BTL în hemopatiile maligne nu a întârziat să se manifeste.
Astfel, au fost elaborate tehnologii specifice pentru identificarea și evaluarea ADN genomic în aceste boli, precum ClonoSEQ Assay bazat pe PCR multiplex și secvenţierea de nouă generaţie ultraprofundă (ultra-deep next generation sequencing, NGS).
Este deja dovedit că în hemopatiile maligne există o heterogenicitate genetică atât spaţială, cât și subclonală, și că aceste boli se însoţesc de niveluri plasmatice ridicate de ADNac și ADNtc, dar, în general, mai reduse decât în tumorile solide și cu mari variaţii între pacienţi și în funcţie de stadiul bolii.
În limfoamele agresive, precum cele cu celule mari difuze tip B și în limfomul mantalei, studii recente folosind o variantă a metodei de mai sus (CAncer Personalised Profiling by deep Sequencing, CAPP-seq) au furnizat rezultate promiţătoare prin utilizarea BTL:
- nivelurile ADNtc înainte de tratament împreună cu răspunsul terapeutic molecular după două cicluri s-au dovedit a fi markeri de prognostic independenţi;
- determinări seriate după terapia de inducţie au identificat recăderea moleculară cu mai multe luni înaintea celei clinice;
- eliminarea timpurie a ADNtc din circulaţie s-a corelat cu evoluţia
favorabilă;
- nivelul ADNtc a constituit un instrument valabil în adoptarea strategiei terapeutice adaptate la riscul bolii pacientului;
- evidenţierea mutaţiilor rezistente la tratament.
Un exemplu de dinamică a ADNtc în cursul tratamentului unui pacient cu limfom este prezentat în figura 1.
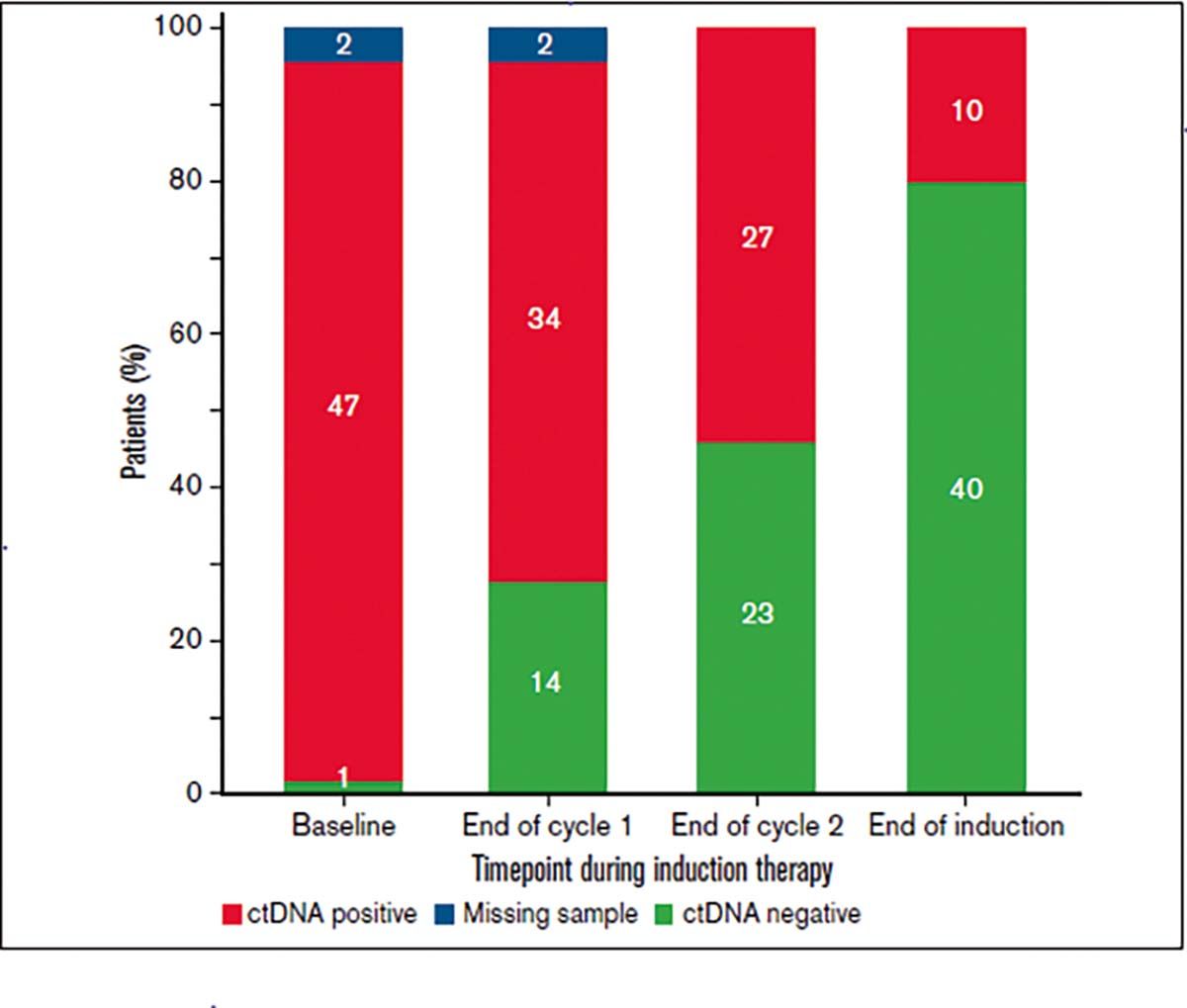
Totuși, BTL nu poate fi utilizată pentru diagnostic în locul biopsiei tisulare, cu excepţia situaţiei ce presupune diagnosticare timpurie și non-invazivă a determinării cerebrale în limfoamele cu celule mari difuze (care „beneficiază” de o mutaţie specifică) la cazurile neabordabile pentru prelevare pentru examen histo/citologic.
În sindromul mielodisplazic (SMD), unde apoptoza excesivă constituie o caracteristică, s-a constatat că nivelurile plasmatice de ADNac sunt semnificativ mai mari comparativ cu cele ale martorilor sănătoși, inclusiv la pacienţii cu SMD cu risc mic, fiind furnizată astfel o cantitate convenabilă de ADNac pentru studiu.
Totodată, profilul mutaţional, analizat prin NGS, al ADNac plasmatic a fost concordant (93%) cu cel al ADN extras din celulele măduvei osoase. În cazul genei SF3B1, frecvenţa alelelor mutante a fost chiar semnificativ mai mare în fracţiunea de ADNac plasmatic.
Aceste date deschid perspectiva utilizării BTL pentru monitorizarea pacienţilor cu SMD, îndeosebi la cei la care nu se obţin celule medulare (SMD fibrotic sau hipoplazic, de exemplu) ori sunt prea fragili pentru puncţii osteo-medulare repetate. În mielomul multiplu (MM), BTL își găsește o aplicaţie practică îndeosebi în formele nesecretorii, oligosecretorii sau cu „scăpare” de lanţuri ușoare.
Cu toată atractivitatea conceptului și a rezultatelor promiţătoare obţinute până în prezent, pentru implementarea BTL în practica hemato-oncologică de rutină se consideră că este necesară depășirea unor obstacole însemnate (sintetizate în figura 2), precum variabilitatea nivelului plasmatic de ADNtc în funcţie de tipul de limfom (mai mare în limfoamele agresive), de stadiul clinico-patologic, de stadiul evolutiv (mai mare în stadiile avansate), de gradul de vascularizare, de rata diferită a apoptozei diverselor clone și subclone, de localizare (ganglionară sau extraganglionară, de exemplu), de dimensiunea tumorii limfatice, de momentul prelevării faţă de cel al tratamentului.
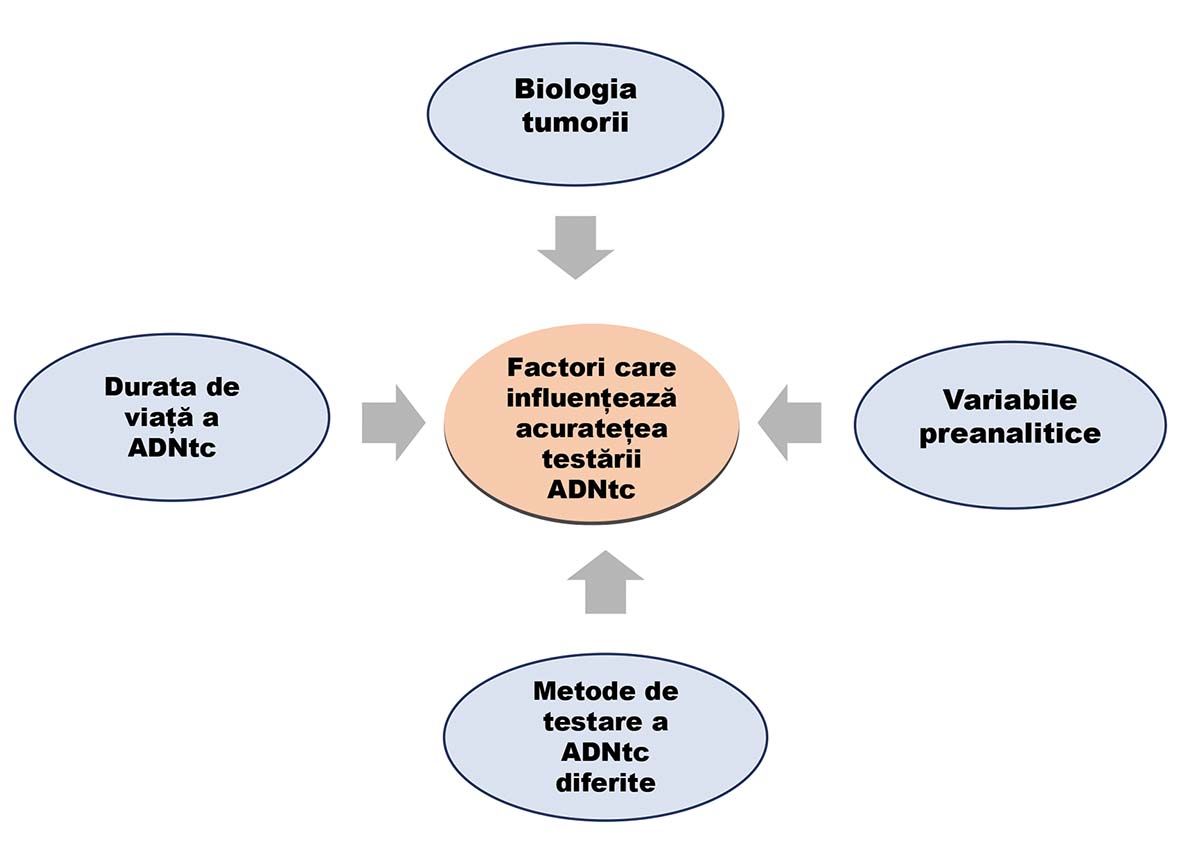
limfoame. Reprodus din (11)
Neelucidate au rămas încă alte influenţe pe care le pot avea o serie de variabile (sarcina, inflamaţia, sindroamele metabolice, diverse alte suferinţe de organ), precum și diferenţele în durata de viaţă a fragmentelor de ADNtc. Pe de altă parte, testele folosite pentru detectarea și analiza ADNtc sunt exigente tehnic (ADNtc reprezintă <0,01% din ADN-ul circulant) și variate, supuse erorilor prin contaminare cu ADN mutant din alte surse (hematopoieza clonală), nestandardizate și neomologate.
În consecinţă, în prezent nu se pune problema de a înlocui biopsia tisulară tumorală clasică, ce rămâne un standard pentru diagnosticul în cancer, și nici imagistica drept instrument de monitorizare, cu BTL (BTL contra BTS). Rolul BTL ar fi doar de a completa BTS cu informaţii privind o caracterizare mai cuprinzătoare a heterogenităţii tumorale, a dinamicii modificărilor moleculare ale celulelor canceroase, informaţii necesare pentru îmbunătăţirea atitudinii terapeutice.
De asemenea, BTL poate furniza date utile în situaţiile în care prelevarea de celule tumorale nu este posibilă. Pentru realizarea acestui deziderat, este necesară însă o bună înţelegere a mecanismelor din spatele observaţiilor, standardizarea și armonizarea metodologiei, validarea procedurii prin studii multicentrice prospective și trialuri ample bine construite, precum și elaborarea de ghiduri și protocoale adecvate.
Citiți și: Rolul driving pressure în ATI
Bibliografie
1. Hocking J. et al. Liquid biopsies for liquid tumors: emerging potential ofcirculating free nucleic acid for the management of hematologic malignancies. Cancer Biol Med 2016,13(2):217
2. Abdulmawjood B. et al. Liquid biopsies in myeloid malignancies. Cancer Drug Resist 2019;2:1044
3. Ming Li et al. Application of data science in circulating tumor DNA detection: A promising avenue towards
liquid biopsy. Front. Oncol. 11:692322
4. Martins I. et al. Liquid Biopsies: Applications for cancer diagnosis and monitoring. Genes 2021,12:349.
5. Lakhotia R. et al. Circulating tumor DNA predicts therapeutic outcome in mantle cell lymphoma. Blood Adv 2022,6,(8):2667
6. Merker J.D. et al. Circulating Tumor DNA Analysis in Patients With Cancer:American Society of Clinical Oncology and College of American Pathologists Joint Review. J Clin Oncol 2018,36(16):1631
7. Rossi D. et al. Liquid biopsy in lymphoma. Haematologica 2019,104(4):648
8. Kurtz D.M. et al. Circulating tumor DNA measurements as early outcome predictors in diffuse Large B-Cell Lymphoma. J Clin Oncol 2018, 36(28):2845
9. Garcia-Gisbert N. et al. Molecular and cytogenetic characterization of myelodysplastic syndromes in cell-free DNA. Adv Hematol 2022, 6(10):3178
10. Ferreira B. et al. Liquid biopsies for multiple myeloma in a time of precision medicine. Journal of Molecular Medicine (2020) 98:513
11. Pirosa M.C. et al. Controversies in the interpretation of liquid biopsy data in lymphoma. HemaSphere (2022) 6:6(e727)
12. Bohers E. et al.cfDNA Sequencing: technological approaches and bioinformatic issues. Pharmaceuticals 2021,14:596
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe