Rolul
central al genomului în dezvoltarea cancerului a fost intuit, la începutul
secolului XX, de către Theodor Boveri (1914), care observă „aberaţii cromozomiale bizare“ în celulele canceroase. După aproape
cinci decenii, au fost descoperite primele anomalii cromozomiale recurente şi
specifice unor tipuri de cancer, cum este translocaţia dintre cromozomii 9 şi
22 („cromozomul Philadelphia“) în
leucemia mieloidă cronică, iar în 1982 a fost identificată prima mutaţie
somatică implicată în cancer (substituţia G>T în codonul 12 al genei HRAS). Această descoperire remarcabilă a
inaugurat epoca cercetării genelor de
cancer şi, până în anul 2000, au fost descoperite circa 80 de gene
implicate în hemopatii maligne şi cancere solide (1).
După 30 de ani de cercetări, încununate cu şase
premii Nobel, s-a stabilit cu certitudine că boala canceroasă este o afecţiune genetică complexă produsă de acumularea unor modificări genetice şi epigenetice, moştenite şi dobândite, în gene multiple; prin aceste evenimente, o
clonă celulară capătă un set complet de capacităţi
distinctive, definitorii („the hallmarks of cancer“), proliferează intens şi
formează o tumoră care evoluează multistadial, creşte necontrolat şi diseminează
(2).
Finalizarea Proiectului Genom Uman (2000) şi
dezvoltarea unor tehnologii performante de analiză a genomului,
transcriptomului şi proteomului celulelor normale şi canceroase1 au produs o revoluţie în cercetările bolii
canceroase, care au culminat recent cu secvenţierea genomului complet al mai
multor cancere frecvente. Au fost determinate tipurile majore de modificări
genetice şi epigenetice din celulele tumorale, stabilindu-se un set complet al
genelor esenţiale (ce codifică proteine sau molecule de ARN necodant) implicate
în cancer şi aprofundându-se mecanismele moleculare ale bolii.
Important este faptul că unele rezultate ale
cercetărilor bolii canceroase au fost deja implementate în oncologia clinică
pentru: • ameliorarea diagnosticului precoce şi stabilirea subtipului molecular al bolii • identificarea unor noi markeri
prognostici • optimizarea tratamentului pentru subgrupe de pacienţi cu acelaşi
tip histologic de cancer dar cu profiluri
de expresie genică diferite • creşterea posibilităţilor terapeutice prin
„inhibarea specifică, ţintită“ („glonţul
magic“) a proteinelor codificate de genele de cancer • monitorizarea
statusului bolii (prin analiza expresiei unor gene implicate în metastazare sau„semnătura metastatică“) şi a
eficienţei tratamentului • managementul susceptibilităţii genetice la cancer
(3). Cert este că progresele înregistrate în ultimii zece ani „pe toate
fronturile“ oncologiei prefigurează „un asalt decisiv“ contra cancerului („împăratul
tuturor bolilor“) (4), responsabil de unul din opt decese în întreaga lume,
şi perspectivele unei „medicini personalizate în cancer“. Despre toate aceste
importante realizări vom discuta într-o suită de articole dedicate genomicii
bolii canceroase sau oncogenomicii.
Gene implicate în
producerea cancerului
În mod normal, o celulă formează, prin
diviziuni succesive, o populaţie sau clonă celulară, prin care se realizează
dezvoltarea embriofetală, creşterea postnatală şi înlocuirea celulelor
senescente sau repararea leziunilor. Aceste procese complexe sunt perfect
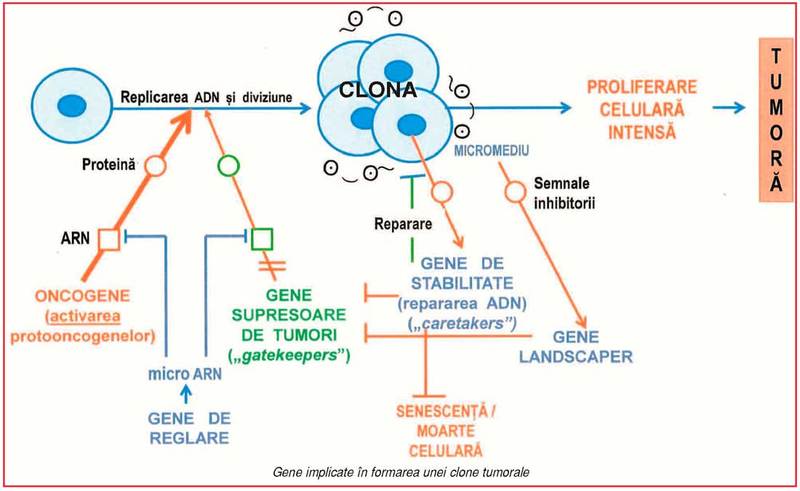
reglate prin acţiunea a trei categorii majore de gene (1):
• genele
proliferative (numite şi protooncogene) codifică proteine implicate în
recepţia şi transmiterea (transducţia) semnalelor mitogene (în special factori
de creştere) la nucleu, stimulând replicarea ADN şi diviziunea celulară; ele
sunt funcţionale în timpul dezvoltării embrionare şi creşterii, fiind de regulă
reprimate la adult (exceptând celulele stem adulte);
• genele
antiproliferative (gene supresoare ale creşterii celulare) reacţionează la
semnalele inhibitorii (externe sau interne), în special la alterările ADN, şi
codifică proteine care opresc proliferarea celulară şi eventual declanşează
apoptoza (moartea celulară programată);
• genele
de reglare, ce codifică molecule mici de ARN necodant, numite micro-ARN
(ARNmi) care, în funcţie de necesităţi, suprimă activitatea genelor
proliferative sau antiproliferative.
În cancer se produc, prin modificări
genetice şi epigenetice, în gene multiple, dereglări profunde ale mecanismelor
care controlează proliferarea celulară; prin aceste evenimente, o clonă celulară
proliferează intens şi formează o tumoră malignă.
Genele implicate în cancer se clasifică funcţional
în oncogene, gene supresoare ale creşterii tumorale şi genele ARNmi (1, 5) (v. figura). Înainte de a descrie
succint aceste categorii de „gene de cancer“, vom sublinia că fără cunoaşterea
acţiunii lor este imposibilă înţelegerea mecanismelor patogenice şi
managementului modern al bolii canceroase.
Oncogenele (exemple: TGFA, EGFR, HER2, SRC, RAF, ERK, MYC etc.)
rezultă prin activarea protooncogenelor, care, în mod normal, sunt reprimate
la adult; se produc cantităţi mari de oncoproteine
(factori de creştere, receptori, proteine de semnalizare intracelulară, factori
de transcripţie, reglatori ai ciclului celular şi ai apoptozei, proteine de
remodelare a cromatinei), implicate în diferite puncte ale căilor de transducţie
a semnalelor mitogene, ce determină o proliferare celulară crescută şi, împreună
cu alte mutaţii, produc cancer. Acest mecanism (descris de Bishop şi Varmus,
Premiul Nobel pentru Medicină, 1989) a generat în ultimii zece ani realizarea
unor medicamente eficace, care „ţintesc specific“ anumite oncoproteine în
exces, de exemplu: BCR-ABL (imatinib, în leucemia mieloidă cronică şi tumorile
gastrointestinale stromale), HER2 (trastuzumab, în cancerul de sân şi cel gastric),
VEGF (bevacizumab, în cancerul colorectal, bronhopulmonar, ovarian), B-RAF
(vemurafenib, în melanoame).
De subliniat că mutaţiile ce produc
activarea oncogenelor2 sunt mutaţii
dominante (An – interesează
numai o genă din perechea de alele), cu „câştig
de funcţie“ a proteinelor codificate şi pentru a produce cancer necesită un
eveniment adiţional (mutaţii în alte gene).
Genele
supresoare ale creşterii tumorale (GST) sau antioncogene (exemple: TP53, APC, RB, BRCA1, BRCA2 etc.)
blochează, în mod normal, creşterea şi proliferarea celulelor, activând
senescenţa şi/sau apoptoza celulară. În cancere, ele sunt inactivate de obicei
prin mutaţii recesive3, succesive, ale
ambelor alele („ipoteza celor două
lovituri“: NN®Na®aa), care produc „o pierdere de funcţie“ a diverselor proteine pe care le codifică,
determinând accelerarea proliferării celulare şi reducerea apoptozei. Unele
persoane se nasc cu o mutaţie constituţională (Na) în GST, iar pierderea
heterozigozităţii (Na®aa) se poate produce printr-o mutaţie
dobândită la vârste tinere, generând „cancere ereditare sau familiale“.
GST au fost clasificate funcţional în trei
categorii (1): genele „gatekeeper“ („portar/paznic“), genele „caretaker“
(„îngrijitor“) şi genele „landscaper” („peisagist“). • Genele gatekeeper blochează parcurgerea
ciclului celular în anumite puncte de
control, opresc proliferarea şi activează apoptoza; de regulă, fiecare tip
celular este caracterizat printr-o anumită genă gatekeeper (de exemplu, gena APC pentru celulele epiteliale intestinale).
• Genele caretaker nu reglează
direct proliferarea celulară, fiind implicate în păstrarea integrităţii/stabilităţii
genomului; de aceea, au mai fost numite „gene
de stabilitate“. Ele participă la depistarea modificărilor/leziunilor
accidentale sau induse ale ADN (ce apar spontan în cursul replicării sau sub acţiunea
unor agenţi mutageni externi/interni) şi repararea lor, prin multiple căi.
Alterările acestor gene cresc frecvenţa de producere şi fixare a mutaţiilor şi
determină instabilitate genomică. • Genele
landscaper controlează micromediul celular (interacţiunile celulă-celulă
sau celulă-matrice extracelulară), care, în mod normal, generează semnale
antiproliferative. Mutaţiile acestor gene determină anomalii stromale care
induc/susţin proliferarea celulară necontrolată.
Genele microARN (ARNmi), mai recent
descoperite, codifică molecule mici de ARN necodant (de circa 22 de
nucleotide), care se cuplează, pe bază de complementaritate, cu secvenţe din
moleculele de ARN mesager ţintă, blocându-le activitatea. Genele ARNmi pot funcţiona
atât ca oncogene, cât şi ca GST, în funcţie de genele pe care le reglează. Mutaţiile
genelor ARNmi (numite şi „oncomirs“)
perturbă activitatea/reglarea celorlalte gene implicate în cancer.
Descoperirea claselor majore de gene
implicate în producerea cancerului, folosind metodele „clasice” ale geneticii
moleculare, a determinat elucidarea multor enigme ale patogeniei bolii
canceroase dar şi multiple aplicaţii practice. Adevărata „revoluţie” în cancer
se prefigurează însă prin aplicarea noilor tehnologii ale „erei omice” care permit analiza aprofundată a genomului,
transcriptomului şi proteomului tumoral. Prin introducerea tehnicilor de secvenţiere
a ADN de generaţia a doua şi a treia (mai rapide, precise, eficace şi mult mai
ieftine) a devenit posibilă secvenţierea completă a genomului mai multor tipuri
frecvente de cancer (sân, plămân, prostată, diverse hemopatii maligne ş.a.). Pe
această bază The International Cancer
Genome Consortium (înfiinţat în 2008) îşi propune ca obiectiv principal
„realizarea unui catalog complet al modificărilor genomice semnificative
asociate cancerului (The Cancer Genome Atlas sau TCGA),
prin analiza a 500 de tumori pentru fiecare din 50 tipuri de cancere diferite,
pentru a accelera cercetările în etiopatogenia şi controlul cancerului“ (6).
Rezultatele obţinute până în prezent (5–8)
relevă că „peisajul“ genomului cancerelor analizate este incredibil de complex.
Fiecare tumoră conţine un număr foarte
mare (între 104–105) de modificări
genetice şi epigenetice diverse:
substituţii nucleotidice (numeroase), mici deleţii şi inserţii („indels“), rearanjări cromozomiale (neaşteptat
de frecvente), creşterea numărului de cópii (amplificări),
alterări în metilarea ADN (de exemplu, hipermetilarea şi deci inactivarea
consecutivă a GST) sau în ARNmi (care pierd funcţia de reglare), inserţia unor
genomuri exogene (oncovirusuri).
Reamintim că mutaţiile sunt schimbări
definitive în secvenţa nucleotidică a ADN iar modificările epigenetice sunt modificări (remodelări) reversibile
ale structurii cromatinei (alcătuită din ADN şi histone), fără schimbarea
secvenţei nucleotidice, care influenţează funcţia genei4. Surprinzător a fost faptul
că modificările epigenetice sunt la fel de frecvente în cancer ca şi mutaţiile,
iar potenţialul lor reversibil aduce speranţa unei terapii de reversie
(inhibarea metilării ADN sau a dezacetilării histonelor) (8).
Toate modificările genetice/epigenetice suntdistribuite aleatoriu, în regiuni
codante (în peste 5.000 de gene) şi necodante din genom, fiecare tumoră având ocombinaţie caracteristică de mutaţii.
Diversitatea şi complexitatea modificărilor genomice este dezarmantă, dar
semnificaţia lor pentru patogenia cancerului este diferită; importante sunt
alterările „genelor de cancer“,
circa 400 (â2% din genom) descoperite până în prezent în mai multe tipuri de
cancere (şi probabil circa 2.000 în total) (5).
Într-adevăr, numai un număr limitat de mutaţii
(deseori comune în mai multe neoplasme), grupateîn genele de cancer, dereglează mecanismele de control al proliferării
celulare şi determină formarea tumorii; ele au fost numite mutaţii conductoare („driver
mutations“). Cele mai multe dintre mutaţiile identificate în tumori nu
influenţează însă biologia tumorală, sunt rezultatul unor modificări
accidentale, distribuite la întâmplare
în genom şi au fost denumite mutaţii
pasagere („passenger mutations“) (6,
8). Se consideră că numai un număr mic de
mutaţii conductoare (mai puţin de zece) sunt necesare pentru iniţierea
clonei canceroase (între două şi cinci mutaţii conductoare „oncogenice“) şi pentru menţinerea/expansiunea tumorală (peste
cinci-şase mutaţii conductoare „de menţinere“)(6, 7).
Rolul central al mutaţiilor conductoare în
geneza şi menţinerea tumorii reprezintă un potenţial „călcâi al lui Ahile“ prin descoperirea medicamentelor necesare
blocării produselor lor. Din această perspectivă a utilităţii clinice, unele
mutaţii conductoare au fost definite ca modificări „acţionabile“ („actionable aberrations“), în sensul că
„implică acţiuni practice“ – deoarece
au impact asupra managementului
cancerului prin utilizarea lor în diagnostic, prognostic şi/sau predicţie; o
parte dintre acestea sunt şi „tratabile“ („druggable
aberrations“) – întrucât proteinele codificate pot fi ţinta unor noi
terapii, care schimbă evoluţia bolii (6). Astfel, amplificarea genei ERBB2 în cancerul de sân, mutaţiile
genei EGFR în cancerul pulmonar fără
celule mici şi mutaţiile BRAF în
melanom sunt aberaţii „acţionabile“ şi „tratabile“, deoarece au valoare prognostică,
produsele lor pot fi inhibate cu terapie ţintită şi sunt predictive pentru
beneficiul acestei terapii. În schimb, mutaţiile genei IDH1 în glioblastoame sunt „acţionabile“ ca biomarkeri prognostici,
dar nu sunt încă „tratabile“ deoarece nu există medicamente ţintite spre
produsul genei. Foarte probabil, oncogenomica va creşte numărul aberaţiilor
potenţial „acţionabile“ şi „tratabile“, iar acest fapt va duce la o amplificare
a capacităţii de a controla şi trata specific un număr din ce în ce mai mare de
cancere.
În acest context, menţionăm că analiza
genomică a unor probe/biopsii multiple din tumora
primară a evidenţiat fenomenul de heterogenitate
intratumorală: existenţa unor subclone minore, ce derivă din clona majoră,
care au mutaţii adiţionale (însă
deseori în aceleaşi gene ca şi în clona iniţială). A devenit cert că genomul evoluează pe măsura progresiei
tumorii. Evoluţia policlonală „ramificată“ determină însă dificultăţi în
folosirea unei terapii ţintite pe o anumită proteină şi explică recurenţa
tumorală după astfel de tratamente (noi mutaţii conductoare ce activează căi de
semnalizare alternative şi conferă rezistenţă la tratament) (7). Dar leziunile
genetice găsite în „trunchiul principal“ (clona iniţială) sunt exprimate şi „în
ramurile sale“ (subclone). În aceste condiţii, se impune schimbarea
strategiilor terapeutice şi direcţionarea lor spre genă (şi nu spre proteina
codificată de genă), urmărind inhibiţia ei funcţională sau restaurarea
structurii ei normale (9).
Analizele întregului genom tumoral în
diferite tipuri de cancer au evidenţiat multe alte date şi fenomene inedite: • noi
clase de „gene de cancer“ ce codifică proteine care modifică histonele,
controlează transcripţia (de exemplu, factori de transcripţie) sau procesarea
transcriptelor, inclusiv procesarea micro-ARN • noi căi şi reţele de
semnalizare, asociate cu subtipuri clinice distincte • „semnătura mutaţională“ (a unor factori mutageni din mediu), „profilul molecular (de expresie)“ şi
terapia ţintită, „semnătura metastatică“ • interacţiunea dintre genele de
cancer (epistazie de amplificare sau de supresie, letalitate sau viabilitate
sintetică) • circa 80% din mutaţiile genelor de cancer sunt dominante şi
codifică proteine care de obicei sunt activate prin mutaţii; acest fapt va amplifica
cercetările de identificare a unor terapii inhibitorii ţintite. Vom relua pe
larg aceste probleme în articolele viitoare.
Deşi s-au descris „modele caracteristice“ de modificări genetice în diferite cancere,
nu se ştie însă dacă achiziţia mutaţiilor este un proces ordonat sau mai exact
dacă este importantă „ordinea“ de achiziţie a modificărilor
genetice/epigenetice sau „combinaţia“
lor specifică. A devenit importantă şi viteza de achiziţie a mutaţiilor,
deoarece universalitatea dogmei gradualismului
(achiziţie treptată, cumulativă) este pusă la îndoială de mutaţiile brutale,
„big bangs“, de tipul atriţiei telomerelor sau „cromotripsiei“ – ruperea simultană multiplă şi reasamblarea
complexă a cromozomilor, descrise în circa 3% din cancere (10).
Toate realizările recente ale oncogenomicii
au deschis calea medicinii personalizate
în cancer, definită ca „o formă de
medicină care foloseşte informaţiile despre genele, proteinele şi mediul unei
persoane pentru prevenirea, diagnosticul şi tratamentul bolii“ (The US
National Cancer Institute). În finalul unui articol special din Journal of Clinical Oncology (2012), o
echipă internaţională de experţi concluzionează: „impactul potenţial al genomicii cancerului este enorm“ (6). Cert
este şi faptul că patogenia şi managementul bolii canceroase „se rescriu“ în
termeni noi, moleculari şi clinicienii care vor să fie „artişti şi nu lăutari“
vor trebui să înveţe şi această nouă partitură „genomică“.
1Integrarea genomicii, transcriptomicii şi
proteomicii prin analiza simultană a
ADN, a ARN şi a proteinelor unei probe de ţesut tumoral a fost recent numită operomică, fiind unul dintre
obiectivele principale ale genomicii bolii canceroase sau oncogenomicii.
2 Activarea protooncogenelor se realizează prin
mecanisme multiple: mutaţii sau translocaţii activatoare, hiperexpresie prin
amplificare sau anomalii de reglare.
3 Există însă şi excepţii de la această regulă;
de exemplu, unele mutaţii ale genei TP53
sunt „dominant negative“, deoarece proteina alelei mutante împiedică funcţia
proteinei alelei normale.
4 Modificările epigenetice realizează fie „o
configuraţie închisă“, prin condensarea cromatinei (produsă de metilarea ADN şi a histonelor), care blochează funcţia
(transcripţia) genelor, fie „o configuraţie deschisă“/decondensarea
cromatinei (prin demetilarea ADN şi/sau acetilarea histonelor), care permite
activitatea genelor.