Diabetul
zaharat de tip 1 (DZ1) este o boală cronică, cu etiologie multifactorială,
produsă prin distrugerea autoimună a celulelor beta (din insulele Langerhans
ale pancreasului), producătoare de insulină, care determină deficienţă de
insulină şi hiperglicemie (5). Prevalenţa crescută a DZ1 în întreaga lume
(aproximativ 1 la 300 persoane în SUA) (1) şi complicaţiile sale pe termen lung
(cetoacidoză, insuficienţă renală, boală cardiacă, accidente vasculare,
neuropatie, cecitate) fac din DZ1 o
serioasă problemă de sănătate publică şi o cauză majoră de dizabilitate şi
de scurtare a duratei de viaţă (4).
Deoarece „în momentul apariţiei primelor
manifestări clinice, masa de celule beta a fost aproape complet distrusă, predicţia şi prevenirea DZ1 reprezintă o
prioritate importantă“ (4). Realizarea acestui deziderat major necesită însă
elucidarea cauzelor şi mecanismelor de producere a bolii. Se ştie cu
certitudine că autoimunitatea este
mecanismul efector principal în DZ1
şi că boala apare numai la anumite persoane, cu o susceptibilitate genetică la autoimunitate, sub acţiunea unor factori de mediu declanşatori (cel mai
frecvent enterovirusuri, în special virusul Coxsackie B4)1 (1, 5). În aceste condiţii, identificarea genelor de susceptibilitate
(de risc) şi a acţiunii lor este baza predicţiei, iar eficienţa prevenţiei DZ1
implică detecţia markerilor moleculari ce caracterizează primele evenimente
patogenice, care au loc înainte de apariţia simptomelor clinice.
Rolul major al
predispoziţiei genetice în producerea DZ1 a fost demonstrat de concordanţa mare
la gemenii monozigoţi, cu aceeaşi ereditate (66% până la vârsta de 40 ani) şi
de agregarea familială crescută (riscul relativ2 la fraţi: ls = 15) – valori care sunt printre cele mai mari
dintre toate bolile comune, demonstrând rolul determinant al eredităţii (2, 4).
Totuşi, factorii de mediu sunt importanţi pentru declanşarea DZ1 la indivizii
susceptibili; mai mult, studiile epidemiologice au evidenţiat, în multe ţări, o
creştere a incidenţei DZ1 în ultimele două-trei decenii (5,3% pe an, în SUA),
explicată prin modificarea tipului şi/sau agresivităţii factorilor de mediu
(2). În acest context, identificarea factorilor cauzali – genetici şi ecologici
– precum şi elucidarea mecanismelor patogenice rămân cruciale, atât pentru
predicţie şi prevenţie, cât şi pentru identificarea unor noi ţinte
terapeutice.
Natura autoimună
a DZ1
este recunoscută de câteva decenii. Se ştie că această afecţiune autoimună esteadaptativă sau antigen-specifică, faţă
de celulele beta care produc insulină (autoantigen), şi este mediată celular, implicând activarea
limfocitelor T care infiltrează insulele Langerhans. Fără a intra în detalii,
accesibile în diferite manuale sau articole de sinteză (5), vom preciza doar câteva
elemente necesare înţelegerii acţiunii genelor de susceptibilitate.
Toleranţa
imunologică naturală
este procesul prin care sistemul imun nu atacă antigenele proprii („self“).
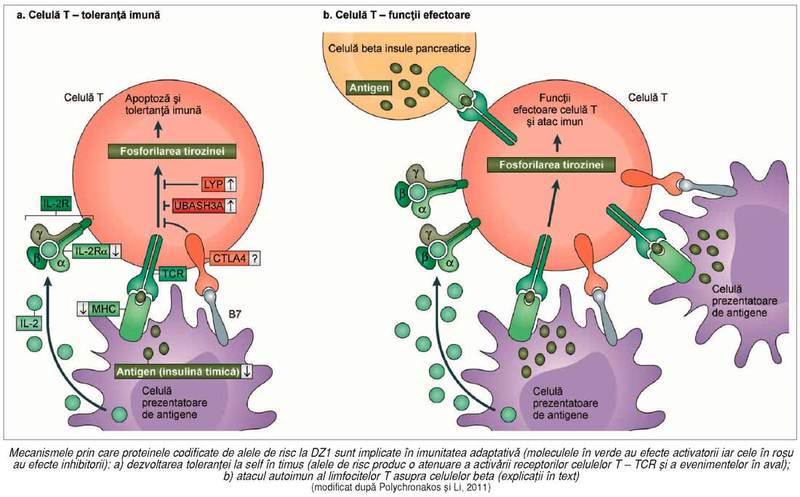
Pentru limfocitele T, acest proces se realizează în special în timus („toleranţă centrală“), în cursul
dezvoltării sistemului imun, unde celulele T sunt expuse la antigenele proprii
exprimate în timus3 (de exemplu, insulina timică)
şi/sau importate din circulaţie. Limfocitele „naive“ (în curs de maturare),
care, prin receptorii TCR („T Cell
Receptor“) recunosc cu mare afinitate complexele formate între moleculele
HLA şi antigenele proprii (v. figura),
sunt eliminate prin apoptoză („selecţie negativă“) din repertoriul celulelor T,
înainte ca ele să devină celule imunocompetente mature, prevenind astfel
autoimunitatea. Dacă prin intervenţia unor „alele
de risc“ ale genelor implicate în susceptibilitatea la DZ1 (v. mai jos) se
produce o pierdere parţială a semnalizării celulelor T (deci o
atenuare a activării TCR de către autoantigene şi/sau inhibiţia unor evenimente
„în aval“ de TCR; v. figura) – o
parte din limfocitele T (ce nu recunosc insulina ca self) „scapă“ eliminării impuse de mecanismele de toleranţă şi participă
la fenomene autoimune (4).
În aceste condiţii de toleranţă incompletă la self (faţă de antigenele
celulelor beta), se pune firesc întrebarea: dacă semnalizarea celulelor T este diminuată (prin acţiunea alelelor de
risc), cum pot aceste limfocite să realizeze „atacul autoimun“? În prezenţa
inflamaţiei („insulită activă“ – iniţiată de imunitatea înnăscută ca răspuns la
agresiunea enterovirusurilor) (5) şi creşterea abundentă a autoantigenelor
(prin distrugerea celulelor beta din insulele Langerhans, produsă de infecţia
virală) – deficienţa parţială a celulelor
T este depăşită prin aceste semnale mai puternice; limfocitele T CD8
citotoxice şi autoreactive (cu specificitate pentru autoantigene) atacă şi
distrug celulele beta (v. figura). În
plus, se produce o perturbare a semnalizării
prin interleukina 2 (IL-2), care compromite funcţia celulelor T reglatoare
– Treg (numite, până nu de mult, şi celule T
supresoare), rolul acestora fiind de a reprima imunitatea mediată celular şi,
mai ales, de a suprima celulele T autoreactive (care scapă proceselor de selecţie
negativă din timus) şi fenomenele autoimune (4).
În concluzie, o coincidenţă nefericită între
creşterea susceptibilităţii la boli autoimune şi acţiunea unui agent declanşator
din mediu determină apariţia DZ1 la un individ vulnerabil. Acest mecanism
evidenţiază importanţa identificării
genelor de susceptibilitate la DZ1, baza fundamentală a predicţiei şi
prevenţiei acestei boli multifactoriale.
Studiul geneticii DZ14 a început în 1970, prin analizele de înlănţuire genică, care au evidenţiat o puternică înlănţuire
cu anumite variante ale genelor HLA („Human Leukocyte Antigen“)
din complexul major de
histocompatibilitate (MHC), de pe cromozomul 6p, care au o contribuţie
majoră la susceptibilitatea bolii; ele au continuat cu studiile de asociere caz-control ale unor „gene candidat“,
implicate în funcţia celulelor beta şi sistemului imun (4); variantele alelice
identificate mai frecvent la bolnavii de DZ1 fiind „variante de risc“ iar cele
prezente mai frecvent la sănătoşi – „variante protective“. Astfel, s-au
descoperit variante ale altor gene asociate cu riscul la DZ1: INS
– ce codifică insulina, PTPN22 – codifică protein-tirozin fosfataza non-receptor tipul 22, CTLA4 – codifică un co-receptor (proteina 4)
asociată cu limfocitele T citotoxice, IL2RA – pentru subunitatea alfa a receptorului interleukinei 2; toate
aceste variante genice conferă însă un
risc mult mai mic la DZ1 comparativ cu variantele HLA. Interesant de
semnalat este faptul că variantele de risc ale acestor gene au fost
identificate şi în alte boli autoimune, sugerând posibilitatea unor căi şi
mecanisme comune.
După 2007, prin folosirea unor tehnici
genomice noi şi performante, s-au realizat (pe cohorte mari de bolnavi şi
martori) studii de asociere la nivelul întregului
genom (GWAS – „genome wide
association studies“), bazate pe ipoteza „boala comună – variantă comună“ – descrise într-un articol
anterior (2). Astfel, cunoaşterea geneticii DZ1 a progresat rapid şi
semnificativ, fiind identificate peste 50 de regiuni genomice/loci non-HLA
(inclusiv cele descrise mai sus) asociate cu un risc crescut la DZ1 (deşi
relativ modest) (5). Dintre genele noi identificate până în prezent în aceste
regiuni genomice, vom menţiona doar genele IFIH1 – care codifică proteina 1 indusă de interferon, ce conţine un
domeniu de helicază c, şi gena UBASH3A (numită şi STH2) – care codifică o proteină nucleară
ce conţine un domeniu SH3 şi este asociată cu ubiquitina. Toate aceste
rezultate foarte recente reprezintă un progres important în descifrarea
geneticii DZ1; ele demonstrează că DZ1
este o boală poligenică foarte complexă, cu un locus major de
susceptibilitate în regiunea HLA şi alţi loci cu efecte mai mici, situaţi înafara
HLA; ei explică împreună 2/3 – 3/4 din riscul genetic la DZ1 (4). Cu
certitudine, arhitectura alelică a genelor de susceptibilitate va conduce la
aplicaţii practice în predicţia bolii,
prin stabilirea unor scoruri de risc, precum şi la înţelegerea mai profundă şi
mai deplină a patogeniei sale moleculare, care va face posibilă descoperirea
unor noi ţinte terapeutice pentru
indivizii cu risc la DZ1. În sprijinul acestei aserţiuni, vom prezenta succint
rolul celor mai importante gene implicate în susceptibilitate la DZ1.
Circa 50% din riscul genetic la DZ1 este
atribuit complexului major de histocompatibilitate (MHC) (1), situat într-o
mică regiune (de 4 Mb) pe braţul scurt al cromozomului 6 (6p21.3) (numită şi
locusul IDDM1 – de la insulin-dependent
diabetes mellitus 1); această regiune conţine peste 200 de gene (40% fiind
implicate în imunitate), foarte polimorfice (alcătuind un veritabil „buletin de
identitate molecular“) şi strâns înlănţuite (1). Cele mai importante pentru
susceptibilitatea la DZ1 sunt genele HLA
de clasă II (DP, DR şi DQ) şi de clasă I (A, B şi C) – o familie de gene
omoloage care codifică proteine de suprafaţă ce prezintă antigenele
limfocitelor T (v. figura). Cele mai
multe alele de susceptibilitate la DZ1 se află în genele HLA de clasă II DR şi
DQ (în special în genele DRB şi DQB ce codifică catenele b) dispuse foarte
aproape una de alta (ceea ce face imposibil de „disecat“ rolul lor individual),
formând haplotipul DR-DQ. Cel mai mare risc la DZ1 este atribuit haplotipurilor DR3-DQ2 şi DR4-DQ85, care
determină scăderea fixării antigenelor,
toleranţă ineficientă la self şi inducţia autoimunităţii (4). Cele două
haplotipuri prezente împreună (constituind genotipul DR3-DQ2/DR4-DQ8) se găsesc
la 30–50% din bolnavii cu DZ1 (comparativ cu 2–3% în populaţia generală); nou-născuţii
cu acest genotip au un risc de 55% de a
dezvolta DZ1 până la vârsta de 12 ani (5). Spre deosebire de haplotipurile
menţionate, unele variante alelice ale genelor HLA de clasă II (de exemplu, DQ6
sau DP4) conferă, dimpotrivă, o protecţie
importantă la DZ1. În final, menţionăm că şi unele alele ale genelor HLA de
clasă I (în special HLA-B18 sau B39 şi HLA-A1 sau A30) joacă un rol în
susceptibilitatea la DZ1, însă mult mai redus comparativ cu genele HLA de clasă
II (1).
Pe locul secund, după genele HLA de clasă
II, privind mărimea riscului de DZ1 se plasează genele INS şi PTPN2. Gena INS
(sau locusul IDDM2), situată pe cromozomul 11p15.5, codifică peptidul
proinsulină; prezintă o variantă alelică care reduce expresia genei INS6 în cursul dezvoltării timusului şi
determină astfel toleranţă imună incompletă la insulină (4, 5) şi dezvoltarea
autoimunităţii pentru DZ1. O altă variantă a genei INS are însă un efect protector. Se speră că elucidarea
mecanismelor acestor procese va conduce la descoperirea unor mijloace terapeutice pentru prevenţia DZ1,
prin creşterea expresiei genei în timus.
Gena PTPN22, localizată pe
cromozomul 1p13, codifică proteina LYP – o tirozin-fosfatază specifică
limfocitelor – care este un reglator
negativ (prin defosforilarea kinazelor) al „cascadei de semnalizare“ ce
produce răspunsul imun, declanşată de fixarea antigenului la receptorii
limfocitelor T (TCR) (v. figura); LYP
joacă, astfel, un rol important în echilibrul dintre toleranţa la self şi
atacul imun. O variantă comună a genei (un SNP nesinonim în poziţia 1858)
produce o modificare a proteinei LYP (620Arg Æ Trp) care scade puternic semnalizarea iniţiată de receptorii TCR la insulină în
cursul dezvoltării timice şi permite celulelor T autoreactive să scape selecţiei
negative, favorizând autoimunitatea. Această alelă creşte riscul la DZ1 dar şi
la alte boli autoimune, care au, probabil, un mecanism comun. În prezent, se
studiază utilizarea unor inhibitori ai
LYP ca terapie potenţială a autoimunităţii (4).
Dintre celelalte gene identificate (prin
GWAS) a fi asociate cu DZ1, vom preciza că geneleIL2RA, CTLA4 şi UBASH3A sunt implicate în reglarea funcţiilor limfocitelor T şi
că variantele lor asociate cu riscul la DZ1 produc – ca şi alela de risc PTPN22
(menţionată mai sus) – o atenuare a
semnalizării TCR la autoantigene, compromiţând toleranţa la self şi favorizând
autoimunitatea, în general. O menţiune specială pentru gena IFIH1 (situată în
regiunea cromozomială 2p24.4), care codifică o helicază ce induce producţia de
interferon; această proteină este un veritabil senzor al infecţiei cu enterovirusuri ARN, în special virusul
Coxsackie B4 (VCB). Polimorfismele genei IFIH1
modifică expresia genei şi răspunsul la
agenţii virali din mediu, fiind asociate fie cu un risc crescut la DZ1 (în
cazul unui alele cu câştig de funcţie şi sinteză crescută a proteinei IFIH1),
fie – invers – cu protecţia puternică la DZ1 (în cazul unei alele cu pierdere
de funcţie şi deci nivel scăzut al sintezei de IFIH1) (1, 5). Vom sublinia, din
nou, că infecţia cu VCB în absenţa predispoziţiei la autoimunitate nu provoacă
DZ1, precum şi faptul că VCB nu este singura cauză declanşatoare din mediu.
Genele/locii asociaţi cu susceptibilitatea
la DZ1 confirmaţi până în prezent explică 2/3 – 3/4 din riscul relativ la boală,
mult mai mult decât în alte boli comune (4); acest fapt permite utilizarea
practică a unor „scoruri de risc“, care facilitează predicţia genetică a
persoanelor vulnerabile (v. mai jos). Există însă şi în cazul DZ1 „o heritabilitate lipsă“ reprezentată de
variante genetice necunoscute (care, probabil, fie au efecte foarte mici, fie
sunt foarte rare) sau de interacţiuni (efecte epigenetice) între factori de
mediu si factori genetici. Identificarea lor va fi posibilă prin utilizarea
unor noi tehnologii, inclusiv de secvenţiere a întregului genom (cu metode mai
rapide şi cu costuri mici) la sute de bolnavi cu DZ1. Se estimează că în
heritabilitatea DZ1 ar putea fi implicate peste 1.000 gene ce codifică proteine
şi circa 500 gene ce codifică ARN (3).
În final, se pune firesc întrebarea: la ce
sunt utile, în medicina practică, recentele studii genetice în DZ1? Răspunsul
poate fi simplu: identificarea şi studiul acţiunii genelor de susceptibilitate
la DZ1 poate contribui decisiv la predicţia
şi prevenţia bolii (depistarea precoce va permite prezervarea celulelor
beta rămase nealterate), precum şi la elaborarea unor noi ţinte şi strategii terapeutice în stadiul preclinic al bolii şi/sau„personalizarea“ intervenţiilor în
funcţie de profilul lor genetic.
Screeningul
genetic
al indivizilor vulnerabili la DZ1 se bazează pe anamneza familială şi vizează
rudele de gradul I ale bolnavilor (cu risc de 10–15 ori mai mare decât populaţia
generală), la care se va determina riscul genetic, în special genotipul
DR3/4-DQ2/8 (folosind tehnicile moderne de stabilire a profilului HLA). Recent,
The Sanger Center (Marea Britanie) a iniţiat realizarea şi dezvoltarea unui imunocip care evaluează ţintit
variantele genelor care s-au dovedit (prin studiile GWA) a fi implicate în
multiple boli autoimune (DZ1, tiroidită autoimună, boala celiacă, boala Addison
etc.); această abordare genomică „bazată pe boală“ va permite aplicarea unor
scoruri de risc, pentru identificarea indivizilor vulnerabili la DZ1 (4, 5).
La nou-născuţii selectaţi prin screening
genetic se vor aplica teste serologice pentru identificarea precoce a indivizilor prediabetici. Biomarkerii serici vizează cele mai precoce
evenimente patogenice (înainte de distrugerea completă a celulelor beta):
prezenţa şi titrul autoanticorpilor asociaţi cu celulele beta insulare, dozarea
peptidului C (prima fază în producerea insulinei) – ambele teste accesibile în
practica actuală – sau, mai recent, studiul metabolomului (de exemplu, creşterea
lipofosfatidilcolinei care precede apariţia autoanticorpilor) şi a limfocitelor
T autoreactive (5). În această „fereastră îngustă de timp“, progresia spre DZ1 poate fi blocată –
prin stimularea activă a toleranţei la self (imunizare cu autoantigeni
specifici pentru a genera producţia de celule Treg, care suprimă celule T
autoreactive), imunoterapie antigen specifică sau nespecifică (vitamina D,
acizi graşi omega 3) şi, eventual, restaurarea celulelor beta afectate (prin
transplant de insule Langerhans, neogeneză sau regenerare) (5). Toate aceste acţiuni
fac obiectul unor programe de studiu (am menţionat anterior programele DAISY şi
TEDDY) şi a unor trialuri preventive sau terapeutice precoce care reprezintă nu
numai „luminiţa de la capătul tunelului“, ci şi o autentică speranţă.
1Alţi factori incriminaţi, dar fără dovezi
directe, sunt: flora bacteriană intestinală, albumina din laptele de vacă,
glutenul din grâu şi, mai ales, deficienţa în vitamina D (factor important
pentru menţinerea toleranţei faţă de propriile celule – self şi protecţia
contra autoimunităţii). Cauzele potenţiale din mediu în declanşarea DZ1 sunt
studiate în prezent prin programele DAISY(Diabetes
and AutoImmunity Study in the Young) şi TEDDY (The Environmental Determinate
of Diabetes in Young) la copii din SUA, Europa de Nord şi Germania (5).
2Riscul relativ (ls) este raportul dintre prevalenţa
bolii la rudele pacientului şi prevalenţa ei în populaţia generală.
3Factorul de transcripţie AIRE („AutoImmune REgulators“) determină
expresia în timus a antigenelor specifice de organ, de exemplu insulina. Mutaţiile
genei AIRE determină sindromul APS1 (poliendocrinopatie
autoimună de tip 1).
4Ca şi în alte boli comune, există câteva
forme monogenice rare de DZ1 – ce asociază şi alte boli autoimune: sindromul APS1, menţionat mai sus, şi sindromul IPEX (dereglare imună,
poliendocrinopatie şi enteropatie legată de X).
5Denumirea completă a acestor haplotipuri este
DRB1*0301-DQB1*0201 şi DRB1*04-DQB1*0302 (numărul alelei fiind indicat după
asterisc). Circa 90% din bolnavii cu DZ1 au cel puţin o copie a acestor
haplotipuri, comparativ cu aproximativ 20% în populaţia generală de origine europeană.
Frecvenţa mare a alelelor de risc pentru DZ1, o boală gravă, este
contrabalansată de eficienţa excepţională a acestor alele faţă de patogeni (4).
6În regiunea promotor a genei INS există o secvenţă cu un număr variabil de repetiţii în tandem
(VNTR); alela „scurtă“ (26–63 de repetiţii), ce conferă riscul la DZ1, reduce
fixarea factorului de transcripţie AIRE la promotorul genei INS, prin modificări specifice ale
histonelor la acest nivel (1, 4); alela „lungă“ (140–230 de repetiţii) are un
efect invers şi protejează persoanele la DZ1.