Diabetul
zaharat tip 2 este o boală metabolică a homeostaziei energetice, caracterizată
prin hiperglicemie şi alterarea metabolismului lipidic, produsă prin incapacitatea celulelor b insulare de a
secreta cantităţi adecvate de insulină, ca răspuns la grade variate de aport
alimentar crescut şi inactivitate fizică – care conduc progresiv la exces
ponderal/obezitate şi rezistenţă la insulină (1).
Există argumente puternice pentru a vorbi de
o veritabilă „pandemie diabetică“: în
septembrie 2011, prevalenţa diabetului zaharat tip 2 (DZ2) în întreaga lume a
fost estimată de Federaţia Internaţională de Diabet (IDF) la 336 de milioane de
indivizi sau 7,6% din populaţia adultă1. În ultimul deceniu, prevalenţa DZ2
are tendinţa de a creşte rapid (se estimează că va ajunge în 2030 la 497 de
milioane sau 8,9% din populaţie), odată cu creşterea ratei obezităţii (2). DZ2
a determinat „o criză în sănătatea
mondială“ ca urmare a prejudiciilor devastatoare pe care le produce în mai
multe organe (boli cardiace, insuficienţă renală cronică, cecitate, accidente
vasculare cerebrale etc.), a mortalităţii (4,6 milioane de decese în 2011 sau
5,2% din mortalitatea globală) şi a costurilor directe şi indirecte (de
exemplu, în SUA, se cheltuiesc 612 milioane dolari pe zi) (2). Toate acestea
impun imperios dezvoltarea şi perfecţionarea strategiilor
preventive şi terapeutice actuale, bazate pe înţelegerea profundă a
fiziopatologiei bolii, la care genomica şi domeniile conexe (transcriptomică,
proteomică, metabolomică) pot contribui decisiv.
Forma comună de DZ2 este considerată o boală multifactorială ce implică o
predispoziţie genetică importantă şi acţiunea unor factori de mediu. Existenţa genelor de susceptibilitate este
dovedită de ratele mari de concordanţă (≥ 90%) a DZ2 la gemenii monozigoţi (cu
aceeaşi ereditate), precum şi de riscul crescut (15%) al DZ2 la rudele de
gradul I ale bolnavilor sau la persoanele care au în familie cel puţin două
rude afectate, indiferent de statusul parental (3). Se estimează că
heritabilitatea (contribuţia eredităţii) la DZ2 depăşeşte 50%. Factorii de risc din mediu sunt
reprezentaţi de: alimentaţia hipercalorică (cu conţinut mare de zahăr şi grăsimi)
şi reducerea activităţii fizice (împreună pot conduce la obezitate), vârsta,
dezechilibrul în micronutrienţi (deficite de vitamină D, vitamină B12),
expunerea la poluanţi organici sintetici, flora microbiană intestinală ş.a.
(2).
Ca şi în alte boli întâlnite frecvent (HTA,
boala coronariană, cancer etc.), în DZ2
există forme monogenice rare de boală2, care reprezintă circa 2–5% din
totalul cazurilor (2, 3). Ele sunt caracterizate prin reducerea secreţiei de insulină şi sunt grupate convenţional în două
categorii: diabetul neonatal (DN) –
ce apare în primele şase luni de viaţă – şi diabetul care debutează la tineri
(MODY – maturity-onset diabetes of the
young), deşi mutaţii diferite în aceeaşi genă se pot manifesta la vârste
diferite (deosebindu-se prin momentul debutului, severitatea hiperglicemiei şi
riscul de complicaţii). În prezent, se consideră
că orice individ la care diabetul debutează neonatal sau în tinereţe şi nu se însoţeşte
de autoanticorpi „insulari“ trebuie evaluat genetic, pentru a nu confunda
formele monogenice cu formele comune, multifactoriale, de DZ1 sau DZ2.
În ultimii zece ani s-au făcut progrese
considerabile în descifrarea cauzelor genetice şi patogeniei formelor
monogenice sau sindromice de DZ2 (produse de defecte ale funcţiei celulelor b
insulare), care au permis nu numai optimizarea diagnosticului şi terapiei lor
(prin adaptarea tratamentului la constituţia genetică a bolnavului), ci şi înţelegerea funcţionării celulelor b
(2). De aceea, înainte de a descrie DN şi MODY, considerăm necesară o scurtă
referire la acest subiect, utilă pentru înţelegerea patogeniei DZ2
multifactorial al adultului.
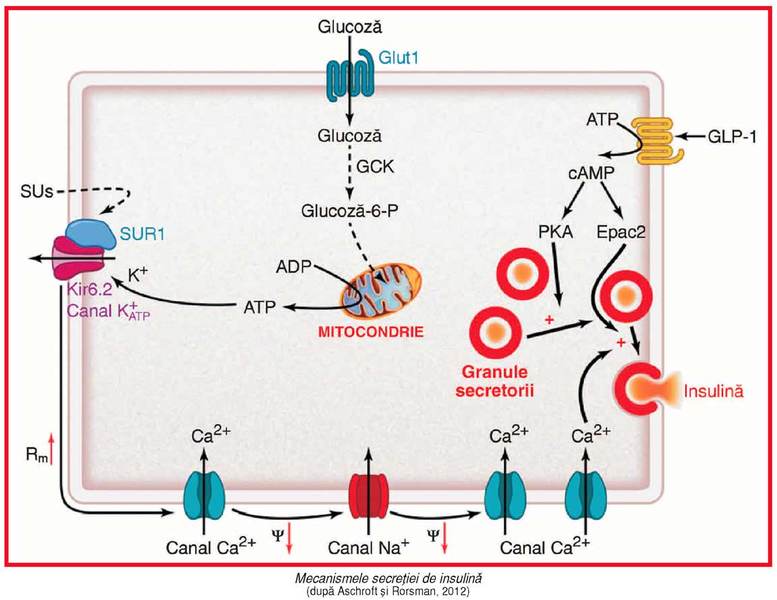
Secreţia de
insulină
de către celulele b insulare se face prin exocitoză(v. fig). Acest proces necesită creşterea intracelulară a concentraţiei de
calciu; influxul de Ca2+ se realizează aproape integral prin canalele
de calciu dependente de voltaj, din membrana plasmatică. Deschiderea lor este
controlată de canalele de potasiu
sensibile la ATP (K+ATP), care au un rol central în secreţia de
insulină3,
realizând legătura dintre metabolismul celulei şi potenţialul de membrană (2).
Factorul principal care iniţiază secreţia de
insulină este creşterea postprandială a nivelului plasmatic de glucoză. După pătrunderea
glucozei în celulele b (cu ajutorul transportorului GLUT1) şi fosforilarea sa
de către glucokinază (GCK), are loc catabolizarea (glicoliza) în mitocondrii şi
formarea de ATP. Creşterea ATP va închide canalele K+ATP şi va produce depolarizarea plasmalemei, care
determină deschiderea canalelor de Ca2+ şi Na+;
influxul de calciu declanşează exocitoza granulelor secretorii cu insulină.
Hormonii (glucagon, somatostatină, incretine) şi neurotransmiţătorii modulează
secreţia de insulină, influenţând eliberarea ei din granulele secretorii, fără
a fi necesară creşterea calciului intracelular; astfel, incretinele secretate postprandial de celulele intestinale (GLP-1 –glucagon-like peptide 1) sau gastrice
(GIP – glucose-dependent insulinotropic
polipeptide) – în prezenţa glucozei din alimente – stimulează exocitoza şi
secreţia insulinei (prin creşterea cAMP) (v.
fig), inhibă secreţia de glucagon şi scad evacuarea gastrică.
Diabetul
neonatal (cca 1:200.000 de nou-născuţi) este produs de mutaţii în genele cu
un rol important în funcţia sau dezvoltarea celulelor b, codificând: subunităţi
ale canalului K+ATP (genele KCNJ11
pentru Kir 6.2 şi ABCC8 pentru SUR
1), insulina sau glucokinaza (2) (v. fig).
DN poate fi permanent sau tranzitoriu (cu o perioadă de remisiune în copilărie),
se asociază cu întârziere de creştere intrauterină şi greutate mică la naştere
pentru o vârstă gestaţională normală (evidenţiind astfel rolul insulinei ca
factor de creştere); DN poate fi, rareori, sindromic4 (asociind alte anomalii, în special
neurologice). Identificarea rolului patogenic major al blocării canalelor K+ATP a determinat înlocuirea cu succes a terapiei
cu insulină prin tratamentul cu sulfonilureice, care deschid aceste canale.
Diabetul cu
debut la tineri
(MODY) înaintea vârstei de 25 de ani este un grup heterogen de afecţiuni (zece
forme produse de mutaţii în gene diferite)5,
cu caracter familial şi transmitere autozomal dominantă. Cele mai frecvente
cazuri sunt produse de mutaţii în gena GCK
care codifică glucokinaza (MODY2) şi gena HNF1A
pentru factorul hepatocitar nuclear 1a (MODY3). În primul caz, anomaliile
glucokinazei scad producţia ATP-dependentă de glucozo-6-fosfat şi perturbă închiderea
canalelor K+ATP, reducând secreţia de insulină (v. fig); rezultă o formă uşoară de
diabet, ce răspunde la tratament dietetic (sulfonilureicele sunt ineficiente) şi
dă rar complicaţii microvasculare. În al doilea caz, anomaliile factorului de
transcripţie hepatocitar perturbă reglarea genelor implicate în funcţia
celulelor b şi realizează o formă mai gravă de diabet, care este însă foarte
sensibilă la tratamentul cu sulfonilureice (demonstrând că celulele b rămân
funcţionale dar sunt defectuos reglate) (2).
În forma
comună, multifactorială, a DZ2 – manifestă la adult – problema genetică
principală este identificarea genelor de
susceptibilitate şi descifrarea mecanismelor prin care acestea determină
vulnerabilitatea la boală. Progrese deosebite s-au realizat în ultimii
cinci-şase ani, prin aplicarea studiilor „caz-control“ de asociere la nivelul întregului
genom (GWAS) a unor variante comune (frecvenţă > 5%) cu genele de risc (3).
Au fost identificate peste 40 de regiuni cromozomiale/loci (care conţin
variante ale unor gene sau elemente reglatoare) asociate cu un risc crescut de
DZ2 (2, 4, 5). Deşi rolul funcţional al unora dintre loci nu este deocamdată
cunoscut şi/sau nu se ştie clar cum aceştia determină predispoziţia la DZ2, s-a
constat că cele mai multe dintre genele de risc identificate produc – prin
mecanisme multiple şi variate – deficienţe iniţiale minore în funcţia celulelor b (de exemplu, genele KCNJ11, TCF7L2, WFS1, HNFIB, GCK, MTNR1B ş.a.)6 şi/sau numărul acestora (de exemplu, genele CDKN2A, CDKN2B)7. Atunci când celulele b
trebuie să facă faţă unui exces de glucoză, disfuncţia devine evidentă şi se
dezvoltă hiperglicemie care, secundar (prin mecanisme glucotoxice şi
glucolipotoxice), accelerează rata insuficienţei insulinice. Numai un număr mic
din locii de susceptibilitate identificaţi influenţează sensibilitatea la insulină (genele PPARG, IRS1, IGF1) sau obezitatea
(gena FTO). Aceste date,
combinate cu numeroase studii funcţionale, au stabilit că mecanismul principal în DZ2 este reducerea secreţiei de insulină şi nu rezistenţa
periferică la insulină, care joacă un rol secundar (2).
CDKN2A, CDKN2B)7. Atunci când celulele b
trebuie să facă faţă unui exces de glucoză, disfuncţia devine evidentă şi se
dezvoltă hiperglicemie care, secundar (prin mecanisme glucotoxice şi
glucolipotoxice), accelerează rata insuficienţei insulinice. Numai un număr mic
din locii de susceptibilitate identificaţi influenţează sensibilitatea la insulină (genele PPARG, IRS1, IGF1) sau obezitatea
(gena FTO). Aceste date,
combinate cu numeroase studii funcţionale, au stabilit că mecanismul principal în DZ2 este reducerea secreţiei de insulină şi nu rezistenţa
periferică la insulină, care joacă un rol secundar (2).
Important de subliniat este faptul că
fiecare individ cu predispoziţie genetică la DZ2 are o combinaţie unică – un profil specific al variantelor genelor de
susceptibilitate, care interacţionează într-un mod particular cu factorii
de mediu, în timpul gestaţiei sau ulterior în cursul vieţii. Dacă se instalează
DZ2, atunci – la fel ca în formele monogenice – genotipuri diferite pot fi asociate cu fenotipuri (subtipuri clinice)
diferite, care ar trebui identificate (2, 6). Această heterogenitate a bolii devine importantă pentru management, care
va fi mai „personalizat“ pe măsură ce vom înţelege individualizarea
mecanismelor patogenice. Un argument suplimentar îl reprezintă
susceptibilitatea individuală diferită a pacienţilor cu DZ2 la anumite complicaţii (nefropatie diabetică,
neuropatii, retinopatii sau boli cardiovasculare). Astfel, studiile genomice au
identificat gene de susceptibilitate asociate cu riscul de nefropatie diabetică(ELMO1, PLEKHH2) sau cu riscul la
retinopatie diabetică (genele SERPING1,
VEGF) (3).
Cu toate progresele remarcabile realizate în
ultimii ani, locii de susceptibilitate la DZ2 identificaţi explică doar ˜10% din
heritabilitatea bolii; restul contribuţiei ereditare la predispoziţia DZ2 ar
putea fi explicată fie prin existenţa unor variante rare (frecvenţă sub 5%) cu
efecte mari (care nu pot fi identificate prin GWAS) şi/sau prin intervenţia
fenomene epigenetice. O atenţie deosebită se acordă recent rolului efectelor epigenetice8 şi
„programării fetale şi neonatale“ în unele boli comune ale adultului (2).
Dovezi „solide“, experimentale şi epidemiologice, stabilesc o legătură între
dieta necorespunzătoare a gravidelor şi/sau întârzierea
de creştere intrauterină şi dezvoltarea la adult a obezităţii, DZ2, HTA,
bolii renale cronice şi bolilor cardiovasculare. De asemenea, există argumente
că diabetul gestaţional, producând
hiperglicemie intrauterină, este puternic implicat în patogenia DZ2. În acest
context, trebuie subliniat că diabetul gestaţional rămâne frecvent
nediagnosticat şi tratat până în ultimele 24–28 săptămâni de sarcină şi că
datele epidemiologice confirmă existenţa unei „pandemii“ de diabet gestaţional
ce o însoţeşte pe cea de DZ2 şi obezitate menţionată la începutul acestui
articol.
Importante sunt şi constatările că alimentaţia
deficitară în vitamină B12 în cursul sarcinii a fost asociată cu adipozitatea şi
rezistenţa la insulină, precum şi faptul că alăptarea la sân protejează contra
dezvoltării DZ2 înaintea vârstei de 21 de ani (2). Toate aceste date subliniazăimportanţa programării fetale şi
neonatale, precum şi rolul unor fenomene epigenetice în originea unor boli
ale adultului şi în mod special a DZ2 (afectând dezvoltarea şi funcţia
celulelor b insulare şi controlul neurohormonal, precum şi disfuncţia ţesutului
adipos) (v. caseta). Devine o
certitudine că perioada fetală (în special în primele 28 de săptămâni de gestaţie)
şi neonatală sau de sugar poate fi decisivă pentru sănătatea metabolică a
adultului şi că o parte substanţială a susceptibilităţii la DZ2 este dobândită încă
din viaţa fetală.
Desigur, clinicienii vor „ataca“ avalanşa
noilor descoperiri genomice în DZ2 cu întrebarea firească: care este importanţa
lor reală şi, mai ales, ce aplicabilitate practică au/vor avea în îmbunătăţirea
capacităţii de a preveni şi trata boala. Înainte de a schiţa un răspuns,
trebuie să precizăm că intervalul dintre descoperiri şi implementarea aplicaţiilor
clinice, care obişnuit este de 20 de ani (6), este în acest caz prea scurt
pentru a realiza „o foaie de arbitraj“ a beneficiilor genomicii DZ2 (care, fireşte,
nu şi-a spus ultimul cuvânt).
Primul element important în procesul
„translaţiei cercetare–clinică“ este, fără îndoială, ameliorarea înţelegerii patogeniei DZ2, baza dezvoltării unor noi
abordări pentru diagnosticul, monitorizarea, tratamentul şi prevenţia bolii.
Evenimentul patogenic primar/primordial care
conduce la dezvoltarea DZ2 este excesul
cronic de substanţe energetice (prin aport alimentar excesiv şi
inactivitate fizică). Boala nu apare însă decât la indivizii cu
susceptibilitate genetică sau epigenetică, care
determină incapacitatea organismului de a stăpâni/controla surplusul energetic.
Obezitatea este un factor-cheie al riscului pentru DZ2, responsabil de creşterea
dramatică a prevalenţei DZ2 în ultimii 50 de ani. Obezitatea scade sensibilitatea
la insulină în ţesuturile periferice9; celulele b compensează acest fenomen prin creşterea
secreţiei de insulină, dar capacitatea lor de a reacţiona depinde de structura
lor genetică (6).
La multe persoane care se alimentează în
exces şi sunt supraponderale sau obeze, DZ2 nu se dezvoltă sau apare foarte târziu
în cursul vieţii, datorită unor mecanisme
adaptative eficace la excesul de calorii; aceste mecanisme menţin aproape
normală concentraţia sanguină a nutrienţilor şi depun excesul lor în ţesutul
adipos subcutanat („alb“; „sănătos“), care se expansionează (1).
La persoanele cu predispoziţie genetică la DZ2, se produce o deficienţă a acestor mecanisme adaptative: • incapacitatea
celulelor beta de a compensa excesul de substanţe energetice prin creşterea
secreţiei de insulină l creşterea secreţiei de glucagon (à jeun şi
postprandial) • reducerea secreţiei de incretine
gastrointestinale (GLP-1, GIP) • creşterea producţiei hepatice de glucoză, prin
gluconeogeneză • dezvoltarea progresivă a rezistenţei periferice la insulină • afectarea
expansiunii ţesutului adipos subcutanat, cu depozitarea excesului de nutrienţi în
ţesutul adipos visceral („brun“) şi organe (ficat, inimă, muşchi scheletic,
pancreas), care suferă leziuni (prin creşterea concentraţiei de citokine
inflamatorii) (1, 2).
Aşa cum am menţionat anterior, cele mai
multe dintre genele de risc identificate produc – prin mecanisme multiple şi
variate – deficienţe iniţiale minore în funcţiaşi/sau masa celulelor b. Astfel,
genomica a produs probabil una din cele mai radicale modificări în cunoaşterea
patogeniei DZ2, stabilind că mecanismul
primordial este reducerea secreţiei de insulină dependentă de glucoză şi nu
rezistenţa la insulină, aşa cum se credea până nu demult (6). Asistăm la o
veritabilă „schimbare de paradigmă“ deoarece rolul patogenic „tradiţional“ al
rezistenţei la insulină a muşchilor scheletici şi a miocardului în DZ2 începe să
fie serios reconsiderat, accentul punându-se în prezent pe deficienţele genetice ale funcţiei10 celulelor b insulare (v. fig.): afectarea uşoară a activităţii glucokinazei şi/sau
canalelor K+ATP duce la o închidere incompletă a canalelor K+ATP, scăderea
influxului de calciu şi a exocitozei insulinei. Inactivitatea musculară
contribuie la excesul caloric, dar aceasta nu este o consecinţă a rezistenţei primare la insulină. În DZ2,
muşchii „se apără“ de steatoză şi stres metabolic, dezvoltând secundar o rezistenţă la insulină, prin reducerea numărului şi funcţiei
mitocondriilor, dependentă de vârstă (1). De aceea, încercările terapeutice
de „a forţa“ această rezistenţă prin creşterea dozei de insulină (fără o
detoxifiere nutritivă concomitentă) pot fi nocive. Mai eficace se dovedesc
tratamentele care stimulează biogeneza sau funcţia mitocondriilor (2).
Îmbunătăţirea cunoştinţelor despre
fiziopatologia DZ2 va permite noi abordări pentru prevenţia, încetinirea
progresiei şi limitarea efectelor bolii, care vor putea reduce consecinţele
medicale şi economice ale pandemiei DZ2. Aşa cum spuneam, obţinerea unor rezultate
concludente prin studiile genomice ale DZ2 necesită timp, dar există speranţe
autentice că vor fi realizate. Pentru a demonstra această „certitudine“, vom încerca
un bilanţ succint al realizărilor actuale.
Variantele genelor de susceptibilitate identificate
prin GWAS au, din păcate, o valoare mică, aproape nulă, în predicţia riscului individual la DZ2. Astfel, cele mai „puternice“
gene de susceptibilitate – MTNR1B, KCNQ1
şi TCF7L2 – care influenţează secreţia
de insulină cresc riscul de DZ2 doar de 1,7–2 ori; celelalte gene au efecte
mult mai mici. Se speră că aplicarea unor „scoruri de risc“, implicând mai
multe alele de susceptibilitate, va permite o „stratificare“ a persoanelor cu
risc genetic, prin definirea unor „grupe de risc“ (2, 5). Deocamdată,
modificarea stilului de viaţă şi mai ales combaterea supraalimentaţiei şi
sedentarismului şi deci a obezităţii au o valoare profilactică mult mai mare.
Progrese semnificative s-au înregistrat în
diagnosticul molecular al formelor monogenice de DZ2 şi adaptarea tratamentului
acestora la constituţia genetică a bolnavului. O astfel de abordare ar putea fi
posibilă în curând şi pentru forma comună, poligenică, a DZ2 care are probabil
subtipuri patogenice şi clinice diferite. Tratamentul actual al DZ2 la adult este
axat, în stadiile iniţiale ale bolii, pe antidiabetice orale şi, ulterior, pe
insulină, ± medicamente care reduc rezistenţa la insulină. În ultimii ani, odată
cu îmbunătăţirea înţelegerii patogeniei DZ2, la care genomica a avut o contribuţie
decisivă, s-au introdus: • terapia bazată pe incretine (analogi stabili ai
GLP-1 sau mimetice ale GLP-1, de tipul exenatid, liraglutid), care cresc
eficient secreţia de insulină • agonişti ai receptorilor cuplaţi cu proteina G
(GPR119, GPR40 ş.a.), care stimulează celulele b, dar şi secreţia de incretine în
celulele intestinale • antagonişti ai receptorilor pentru interleukina 1, care îmbunătăţesc
funcţia celulelor b (1, 2). Toate aceste terapii au însă un impact redus asupra progresiei DZ2, considerat o boală
cronică care nu poate fi vindecată şi care necesită tratament pe toată durata
vieţii.
În ultimii zece ani, acest punct de vedere
este pus în discuţie de două proceduri foarte promiţătoare, dar încă nevalidate
de studii mai ample: • restricţia
energetică severă (600 Kcal/zi), care într-o săptămână remite un DZ2
recunoscut • chirurgia bariatrică11 pentru
obezitate (reducerea dimensiunilor stomacului) care, printr-un mecanism
necunoscut (probabil amplifică eliberarea de incretine în tractul gastrointestinal), creşte secreţia de insulină
şi sensibilitatea periferică la insulină, producând remisiuni spectaculoase ale
DZ2, înainte de a obţine o scădere evidentă a greutăţii (2). La aceste două
„evenimente terapeutice“, descoperirea prin analize genomice a unor gene
implicate în patogenia bolii duce la identificarea
unor noi ţinte terapeutice; astfel, genele PPARG şi KCNJ11 codifică
proteine ce au devenit „ţinte“ pentru glitazone şi, respectiv, sulfonilureice,
folosite deja în terapia DZ2. Alte opţiuni atractive sunt „abordarea“
produselor genelor MTNR1B – codifică
un receptor pentru melatonină (blocat de bromocriptină) – şi SL30A8 – codifică un transportor de zinc implicat în formarea granulelor secretorii
de insulină (1, 6).
În domeniul prevenţiei DZ2, aşa cum precizam mai sus, o parte substanţială a
susceptibilităţii la DZ2 este dobândită, prin fenomene epigenetice, în perioada
fetală şi neonatală – crucială pentru sănătatea adultului. De aceea, asistenţa optimă în cursul sarcinii şi după
naştere – printr-o dietă corespunzătoare, exerciţii fizice, îngrijire
obstetricală şi neonatală corectă şi alăptare, mai ales în grupele de populaţie
cu risc crescut (inclusiv cele cu nivel socioeconomic redus sau ce se
restabilesc din rural în urban) – poate fi decisivă pentru o prevenţie eficace
a DZ2 (1). În acest context, se impune cu necesitate screeningul precoce al
diabetului gestaţional (până în 24–28 de săptămâni) şi abordarea sa eficace
printr-o alimentaţie corespunzătoare, un stil de viaţă sănătos şi/sau tratament
cu insulină.
În încheiere, vom afirma încă o dată că
opiniile multor cercetători şi clinicieni converg spre recunoaşterea largă a
rolului potenţial deosebit de important al fenomenelor genetice şi epigenetice în
managementul complex al DZ2, care, evident, trebuie cunoscute şi de
practicieni.
1În SUA, DZ2 afectează ˜12% din populaţia generală şi
peste 25% din persoanele peste 65 de ani.
2Tratatele clasice de diabetologie nu includ în
DZ2 formele monogenice; tendinţa actuală, bazată pe o patogenie comună, este de
a include în DZ2 atât formele monogenice, cât şi cele poligenice (1, 6).
3Derivaţii de sulfoniluree – folosiţi în
tratamentul DZ2 – se fixează pe canalele K+ATP şi le închid, stimulând secreţia de insulină.
4De
exemplu, sindromul DEND,
caracterizat prin întârziere de dezvoltare
motorie şi retard mental, epilepsie,neonatal diabetes.
5MODY nu trebuie confundat cu diabetul autoimun latent (LADA sau
DZ1,5) – o formă de DZ1 cu progresie lentă.
6Variantele unora dintre aceste gene sunt
implicate atât în formele monogenice de DZ2, cât şi în cele multifactoriale.
7Denumirea
şi rolul funcţional al acestor gene pot fi obţinute, de cei interesaţi de
subiect, din enciclopedia electronică Wikipedia.
8Epigenetica studiază modificările
în funcţia genomului (activarea sau inactivarea unor gene normale, fără mutaţii)
prin reorganizarea cromatinei (alcătuită din ADN şi histone) în configuraţii
accesibile („deschise“) sau inaccesibile („închise“) fixării factorilor ce
declanşează transcripţia şi expresia genelor; ele sunt produse prin
metilarea/demetilarea ADN sau acetilarea/dezacetilarea histonelor, sub acţiunea
unor agenţi din mediu.
9Un alt mecanism posibil: depozitele
intrainsulare de acizi graşi inhibă funcţia celulelor beta.
10Abilitatea
GLP-1 şi a chirurgiei bariatrice de a restaura secreţia de insulină dependentă
de glucoză şi nivelul normal al glicemiei la pacienţii cu DZ2 argumentează
ipoteza că masa celulelor b şi conţinutul de insulină nu sunt reduse sever în
această formă de boală.
11De la cuvintele greceşti baros = greutate şi iatros =
medicament/ tratament.
12Mutaţiile genei HNF4A au fost identificate într-o formă genetică de diabet zaharat
(MODY1), precum şi în forme sporadice de DZ2 la adult.
 CDKN2A, CDKN2B)7. Atunci când celulele b
trebuie să facă faţă unui exces de glucoză, disfuncţia devine evidentă şi se
dezvoltă hiperglicemie care, secundar (prin mecanisme glucotoxice şi
glucolipotoxice), accelerează rata insuficienţei insulinice. Numai un număr mic
din locii de susceptibilitate identificaţi influenţează sensibilitatea la insulină (genele PPARG, IRS1, IGF1) sau obezitatea
(gena FTO). Aceste date,
combinate cu numeroase studii funcţionale, au stabilit că mecanismul principal în DZ2 este reducerea secreţiei de insulină şi nu rezistenţa
periferică la insulină, care joacă un rol secundar (2).
CDKN2A, CDKN2B)7. Atunci când celulele b
trebuie să facă faţă unui exces de glucoză, disfuncţia devine evidentă şi se
dezvoltă hiperglicemie care, secundar (prin mecanisme glucotoxice şi
glucolipotoxice), accelerează rata insuficienţei insulinice. Numai un număr mic
din locii de susceptibilitate identificaţi influenţează sensibilitatea la insulină (genele PPARG, IRS1, IGF1) sau obezitatea
(gena FTO). Aceste date,
combinate cu numeroase studii funcţionale, au stabilit că mecanismul principal în DZ2 este reducerea secreţiei de insulină şi nu rezistenţa
periferică la insulină, care joacă un rol secundar (2).