În terapia bolilor maligne hematologice s-au înregistrat progrese considerabile, mare parte dintre acestea datorate utilizării, fie izolată, fie în combinaţie cu alte medicamente, a imunoterapiei.
Fără a fi apanajul exclusiv al oncohematologiei, imunoterapia a cunoscut progrese considerabile în acest domeniu și datorită câtorva particularităţi ale ţesutului hematopoietic, precum: sensibilitatea celulelor sale la atacul imunologic, contactul strâns și permanent dintre celulele malignizate ale acestuia și cele ale sistemului imun, originea comună a celulelor maligne și a celor hematopoietice, obţinerea mai facilă a eșantioanelor de ţesut și chiar a celulelor individuale pentru studiu.
Imunoterapia bolilor maligne hematologice a urmat, în paralel sau succesiv, mai multe direcţii, care pot fi sintetizate astfel: imunoterapia umorală, reprezentată în esenţă de anticorpii monoclonali, și imunoterapia celulară, reprezentată în principal de limfocitele T autologe modificate sau nu genetic. La acestea se adaugă strategiile de vaccinare antitumorală, care, deși promiţătoare, nu au atins încă stadiul terapeutic, precum și alte produse farmaceutice (Figura 1).
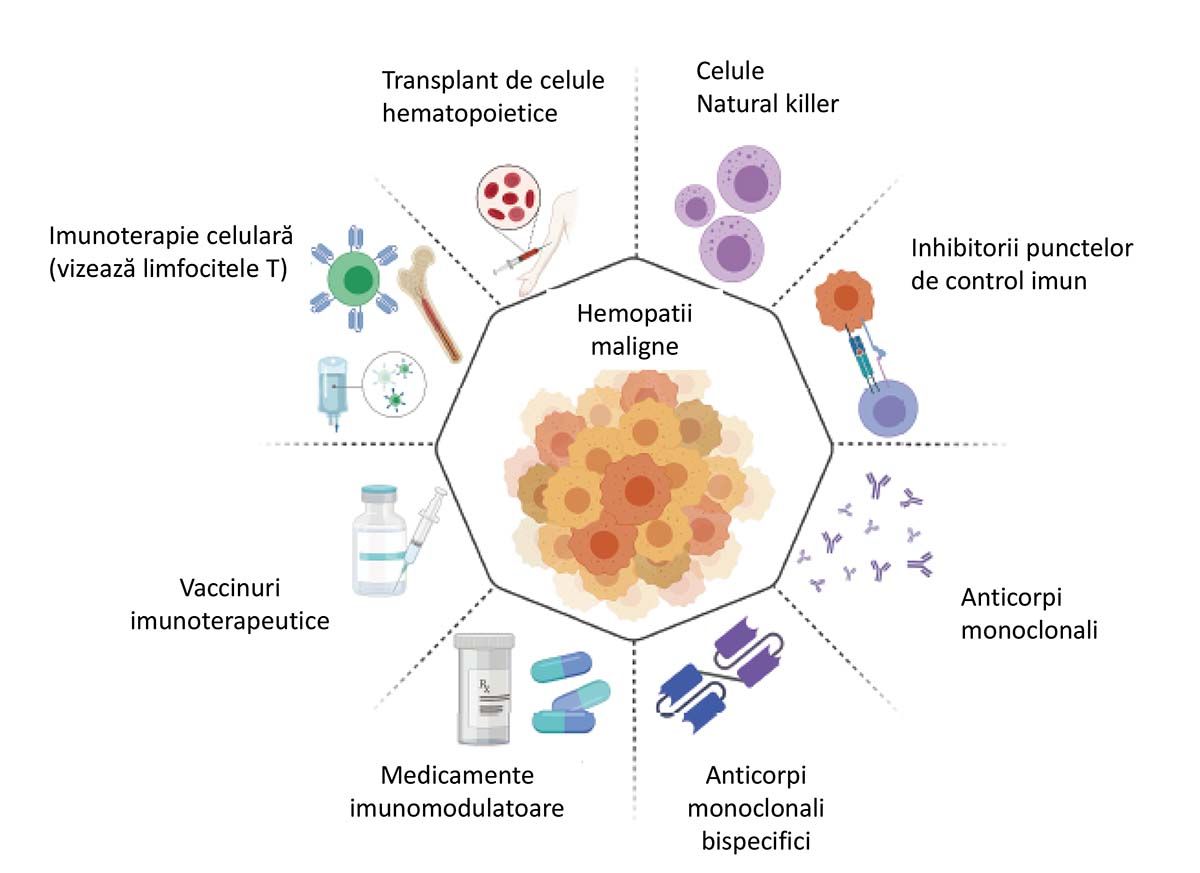
Reprodus din Tawfik ES, 2021
Imunoterapia s-a impus atât ca tratament de primă linie, cât și în cazul recăderilor. Aceasta s-a datorat fie eficacităţii sale, în acele cazuri în care terapia convenţională bazată pe chimio-radioterapie și transplant medular și-a atins limitele, fie pentru că s-a dovedit superioară sau capabilă să potenţeze semnificativ efectele benefice ale terapiei convenţionale, dovedindu-se totodată mai puţin toxică. Ea, practic, a revoluţionat abordarea malignităţilor hematologice în ultimii ani, oferind noi speranţe de ameliorare a calităţii vieţii, de creștere a duratei de supravieţuire și chiar de vindecare a pacienţilor.
Definiţi simplu ca anticorpi având structură identică și specificitate pentru un singur epitop, produși in vitro prin proceduri specifice de inginerie genetică, anticorpii monoclonali au constituit cea mai de succes strategie terapeutică aplicabilă în malignităţile hematologice și nu numai din ultimii 20 de ani. Efectul antitumoral are la bază un mecanism complex.
El constă din legarea de antigene-ţintă și din citoliză pe căi cu pondere variabilă, precum activarea complementului, a fagocitozei de către celule purtătoare ale fragmentului Fc, accelerarea apoptozei și imunomodularea limfocitelor T. Anticorpii monoclonali cu acţiune terapeutică utilizaţi în oncohematologie pot fi grupaţi după cum urmează:
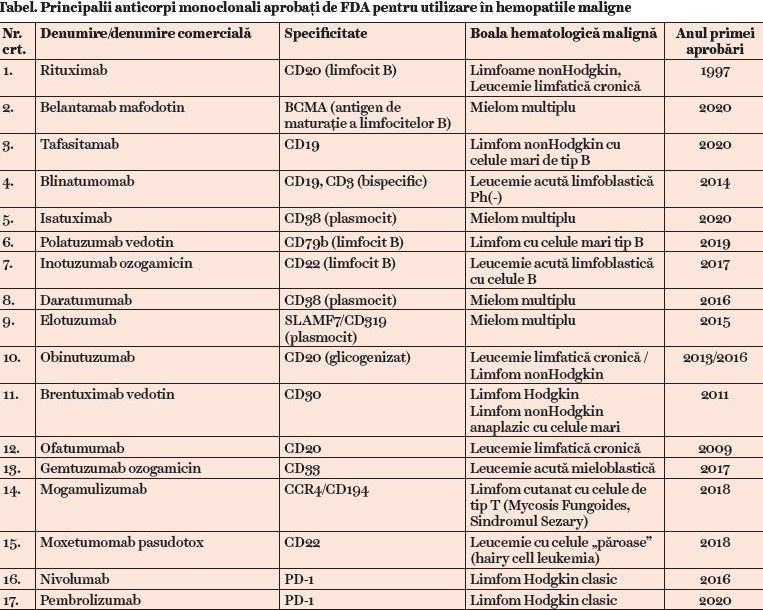
Anticorpii monoclonali simpli („naked”) au început să fie folosiţi în terapia hemopatiilor maligne din anul 1980 prin produsul rituximab (cu specificitate pentru antigenul CD20 prezent pe limfocitele B normale și maligne). Acesta a fost acceptat pentru utilizare în practica medicală în tratamentul limfoproliferărilor cronice cu limfocite B începând cu 1997.
A fost primul anticorp monoclonal aprobat în terapia cancerului, marcând astfel începutul parcursului atât de merituos al imunoterapiei antineoplazice. Anticorpii monoclonali sunt utilizaţi atât în monoterapie, cât și asociaţi cu chimioterapia citostatică, crescându-i semnificativ eficienţa. De exemplu, combinaţia R-CHOP (rituximab + vincristin + hidroxidaunorubicin + ciclofosfamid + prednison) a devenit un tratament standard în limfoamele nonHodgkiniene până în zilele noastre. Ulterior, au fost aprobaţi de FDA și alţi produși asemănători (Tabel), dar numai rituximab există și sub formă de biosimilar (din 2017).
Conjugatele anticorp-agent citotoxic (imunotoxine) au la bază tot un anticorp monoclonal, însă acesta este legat chimic cu o substanţă cu efect toxic pentru celula-ţintă, substanţă obţinută din bacterii, din plante sau prin sinteză.
Anticorpul are rolul de a se cupla cu un antigen de pe celula-ţintă și de a introduce în aceasta citotoxina, care amplifică efectul citolitic. Reprezentativi sunt gemtuzumab ozogamicin, cu specificitate pentru antigenul CD33, utilizat în leucemia acută mieloblastică; brentuximab vedotin, un anti-CD30 aplicat în limfomul Hodgkin și în unele limfoame nonHodgkiniene, ca limfomul anaplazic cu celule mari, unele limfoame cutanate cu limfocite T; moxetumomab pasudotox, indicat în leucemia cu celule „păroase”; inotuzumab ozogamicin, un anti-CD22 folosit în leucemia acută limfoblastică tip B (Tabel).
Anticorpii monoclonali bispecifici (abreviat BiTEs) reprezintă o achiziţie mai recentă, ce aparţine atât imunoterapiei umorale, cât și celei celulare. Ei constau din fragmente de anticorpi monoclonali cu specificităţi diferite, reunite într-un singur produs, ce se poate lega de două antigene diferite aflate pe celule diferite, conectându-le.
De exemplu, legare de celule-ţintă tumorale și respectiv de celule efectoare citotoxice (limfocite T sau NK). În acest caz, anticorpii monoclonali au rol de punte între celula-ţintă și cea imunocompetentă, și nu de agent efector, de unde și denumirea de „angajator al unei legături” (bispecific T-cell engager).
Prototipul acestui tip de imunoterapic este blinatumomab, un anticorp monoclonal cu specificitate atât pentru antigenul CD19 aflat pe limfocitele B (prezent și pe limfoblaști), cât și pentru antigenul CD3 aflat pe limfocitele T citotoxice. Este indicat în terapia leucemiei acute
limfoblastice tip B.
Inhibitorii punctelor de control imun sunt anticorpi monoclonali cu specificitate fie pentru proteina PD-1, fie pentru proteina PD-L1. Proteinele PD-1, denumite „puncte de control imun” („immune checkpoints”), sunt situate pe suprafaţa limfocitelor T, având rol de control al activării lor. PD-L1 este ligandul pentru PD-1 și există în cantităţi variabile pe diferite celule tumorale.
Legarea PD-L1 de PD-1 determină supresarea activităţii citotoxice a limfocitelor T asupra celulelor tumorale, iar blocarea acestei legări de către anticorpi anti-PD-1 sau anti-PD-L1 restabilește funcţia limfocitelor (Figura 2).
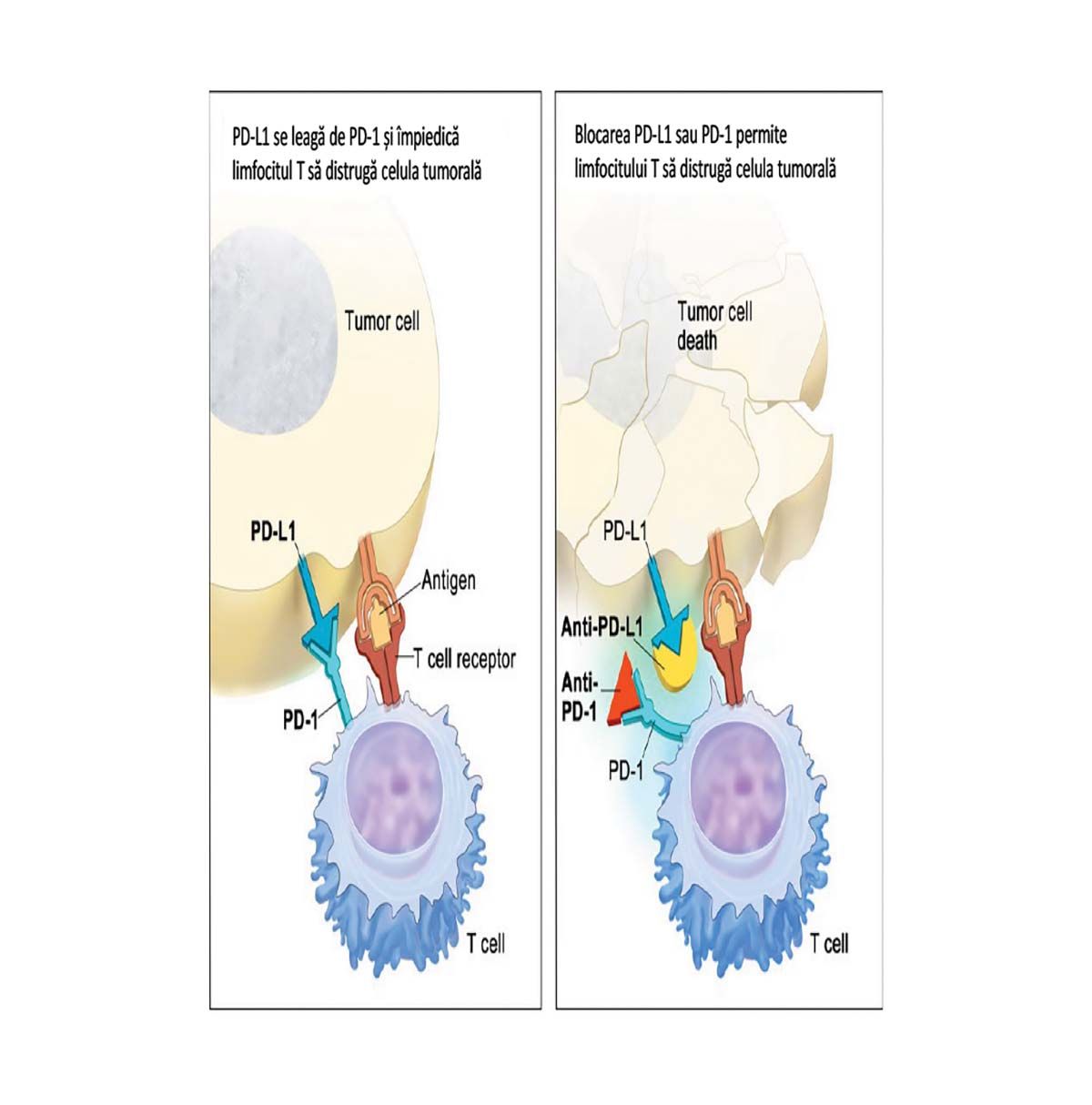
Produșii din această categorie care s-au dovedit a avea acţiune terapeutică în hemopatiile maligne nu au furnizat rezultate comparabile cu cele din terapia tumorilor solide, cu excepţia limfomului Hodgkin clasic rezistent sau în recădere. Acesta a prezentat o proporţie de răspunsuri de 87% pentru nivolumab și de 65% pentru pembrolizumab, ambele fiind anti-PD-1. Faptul a fost explicat prin supraexpresia ligandului PD-L1 pe celulele Reed-Sternberg, combinată cu bogăţia de limfocite T din granulomul Hodgkin.
Trebuie menţionate două aspecte referitoare la anticorpii monoclonali. În primul rând, ei manifestă totuși o eficacitate limitată în monoterapie (de exemplu, rata de răspunsuri la rituximab în limfomul cu celule mari este de doar 37%, cea la chimioterapie tip CHOP de 69% și la terapia standard de astăzi R-CHOP – de 83%).
În al doilea rând, chiar dacă prezintă o toxicitate mai redusă și diferită de cea a chimioterapicelor, nu sunt lipsiţi de efecte adverse, acestea fiind uneori redutabile, precum manifestări autoimune severe induse de inhibitorii punctelor de control imun, ca urmare a activării concomitente a limfocitelor T autoreactive.
Acţiunea lor antitumorală, incomplet cunoscută, se realizează prin mecanisme multiple, precum creșterea sintezei de IL-2 și de interferon-γ, efect antiangiogenic, activarea celulelor dendritice, stimularea limfocitelor T, modularea limfocitelor NK.
Reprezentanţii aprobaţi ai acestei grupe sunt talidomida, lenalidomida și pomalidomida. Aceștia sunt utilizaţi cu precădere în mielomul multiplu, dar și în sindromul mielodisplazic și în unele limfoame nonHodgkiniene (folicular, al mantalei, de zonă marginală), în cazul lenalidomidei.
Reprezintă un grup de proteine secretate de celule ca răspuns la diverși stimuli infecţioși și tumorali, având efect antiviral și antitumoral atât direct, cât și indirect, prin proprietăţile sale imunoregulatoare complexe.
Au fost aprobate mai multe preparate, precum interferonul alfa-2b, interferonul alfa-2a, pentru utilizare în leucemia mieloidă cronică (LMC), în monoterapie sau în asociere cu citozinarabinozid, în leucemia cu celule păroase (hairy cell leukemia), în limfomul folicular, în asociere cu chimioterapie CHOP, limfomul cutanat tip T, mielomul multiplu (tratament de întreţinere în faza de platou).
De asemenea, a fost recomandat de către European Leukemia Net și National Comprehensive Cancer Network (SUA) pentru utilizare „off label” în mieloproliferările cronice altele decât LMC. Ponderea imunoterapiei cu interferon s-a redus semnificativ în ultima decadă ca urmare a introducerii unor medicamente noi, mai performante și mai bine tolerate.
Citiți și: Diagnosticul mielomului multiplu, o problemă pentru sistemul sanitar?
1. Tawfik A. E. et al. Immunotherapy in hematological malignancies: recent advances and open questions Immunotherapy 2021,13(14):1215
2. Tian Z. et al. Bispecific T cell engagers: an emerging therapy for management of hematologic malignancies. J Hematol Oncol 2021,14:75
3. Lesch S., Gill S. The promise and perils of immunotherapy. Blood Adv 2021,5(18):3709
4. Duell J. et al. Bispecific antibodies in the treatment of hematologic malignancies. Clinical Pharmacology & Therapeutics, 2019,106(4):781
5. How J., Hobbs G. Use of Interferon Alfa in the Treatment of Myeloproliferative Neoplasms: Perspectives and Review of the Literature. Cancers (Basel) 2020;12(7):1954.
6. Abdolvahab M.H. et al. Interferons: role in cancer therapy. Review. Future Medicine 2020, doi: 10.2217/imt-2019-0217
7. Ji-Yoon Noh et al. Immunotherapy in Hematologic Malignancies: emerging therapies and novel approaches. Int. J. Mol. Sci. 2020, 21: 8000
8. Dong S., Ghobrial I. M. Immunotherapy for hematological malignancies. Life Sci (Westlake Village). 2019;1(1):
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe