
Strategia terapeutică fundamentală în EH este reprezentată de abordarea focalizată pe modificarea microbiotei intestinale (gut-centric therapy) prin intervenţii dietetice și non-dietetice.
Strategia terapeutică fundamentală în EH este reprezentată de abordarea focalizată pe modificarea microbiotei intestinale (gut-centric therapy) prin intervenţii dietetice și non-dietetice, dat fiind rolul proeminent al disbiozei intestinale și axei intestin-ficat-creier în patogeneza EH.
Managementul EH are ca scop reducerea hiperamoniemiei și inflamaţiei sistemice și modularea microbiotei intestinale.
Encefalopatia hepatică (EH) este o complicaţie neuro-psihiatrică frecventă și severă a cirozei hepatice (CH), ce contribuie substanţial la morbiditatea și mortalitatea asociate acestei afecţiuni și are un impact major asupra calităţii vieţii pacienţilor și familiilor acestora. EH constă într-o disfuncţie cerebrală cauzată de insuficienţa hepatică și șunturile porto-sistemice și se manifestă printr-un larg spectru de modificări neurocognitive: de la manifestări minime, subclinice până la alterarea stării de conștienţă, a personalităţii, cogniţiei și funcţiilor motorii și comă hepatică.
Patogeneza EH
Deși patogeneza EH nu este complet elucidată, studii recente evidenţiază intervenţia sinergică a următoarelor mecanisme: disbioza intestinală, alterarea permeabilităţii intestinale, disfuncţia imună și inflamaţia sistemică.
În ciroza hepatică, catabolismul hepatic al compușilor endogeni neurotoxici produși la nivel intestinal este compromis, ca urmare a șunturilor porto-sistemice și insuficienţei hepatice. Acești compuși intră în circulaţia sistemică și penetrează bariera hemato-encefalică. Factori variaţi cooperează în apariţia EH: disbioza intestinală, hiperpermeabilitatea intestinală, sindromul de poluare bacteriană intestinală, răspunsul inflamator sistemic și neuroinflamaţia, stresul oxidativ, anomalii ale metabolismului azotat, alterarea neurotransmisiei cerebrale.
În particular, EH poate fi privită ca o perturbare a funcţionalităţii axei intestin-ficat-creier: modificarea compoziţiei și funcţiilor microbiomului intestinal în asociere cu alterarea permeabilităţii intestinale determină endotoxemie și translocare bacteriană care, la rândul lor, induc un răspuns inflamator sistemic și la nivelul sistemului nervos central (SNC), reflectat în anomaliile cognitive caracteristice EH.

În asociere cu tratamentul farmacologic, intervenţiile dietetice au un rol esenţial în managementul EH, prin efectul asupra metabolismului azotat, efectele benefice asupra microbiotei intestinale, reducerea eliberării de endotoxine și citokine proinflamatorii și ameliorarea statusului cognitiv la pacienţii cu CH.
Variate strategii intervenţionale sunt propuse în acest scop: modularea aportului și sursei proteinelor alimentare, aportul crescut de fibre alimentare, utilizarea alimentelor cu proprietăţi pre- și probiotice (iaurt etc.). Ghidurile societăţilor internaţionale (EASL, AASLD, ESPEN) recomandă ca pacienţii cu CH decompensată să beneficieze de un un aport caloric zilnic de 35-40 kcal/kg, dintre care 40-60% hidrocarbonate complexe și 25-50% lipide.
Aportul adecvat de proteine este esenţial și bine tolerat de pacienţii cu ciroză și EH. Restricţia de proteine în dietă nu mai este recomandată în hepatologia modernă, deoarece catabolismul proteic în scopul producerii de energie accentuează malnutriţia și sarcopenia ciroticului și crește nivelul amoniului seric.
Ghidurile ISHEN, EASL, AASLD, ESPEN recomandă o dietă normo- sau hiperproteică, conţinând 1,2-1,5 g proteine/kg/zi, în raport cu gradul de decompensare şi denutriţie. Nu numai cantitatea, ci și sursa și distribuţia aportului circadian de proteine sunt importante.
Toleranţa pentru proteinele din dietă diferă în raport cu sursa alimentară, următoarea ierarhie fiind recomandată: vegetale>cazeină>pește>carne albă>carne roșie>organe/sânge. Efectul benefic al dietelor bazate pe proteine vegetale și cazeină a fost demonstrat în numeroase studii și constă în prevenirea recurenţelor EH, ameliorarea funcţiei cognitive și modificărilor electroencefalografice, reducerea nivelului amoniului seric, creșterea calităţii vieţii.
Superioritatea dietelor vegetale rezultă din următoarele proprietăţi:
Patternul alimentar și distribuţia egală a proteinelor în decursul zilei sunt principii importante pentru asigurarea utilizării corecte a substraturilor la pacientul cirotic. Astfel, ruta orală este recomandată ori de câte ori este posibil, iar stilul alimentar recomandat constă în mese reduse cantitativ („snacks”) în cursul perioadei de veghe (trei mese principale și trei gustări), cu distribuţia egală a proteinelor și evitarea posturilor mai mari de 3-6 ore (induc catabolismul proteic, producţia de amoniu și accentuează denutriţia). S-a demonstrat că o cină târzie conţinând 50 g de glucide complexe și administrarea unui supliment proteic matinal au un efect benefic asupra utilizării substraturilor și metabolismului azotat.
Insuficienţa hepatică, reducerea rezervelor, malabsorbţia și aportul inadecvat de nutrienţi determină variate deficite de vitamine, electroliţi și micronutrienţi la pacienţii cu ciroză și EH. Dintre acestea, deficiul vitaminelor din complexul B, îndeosebi B1, se asociază cu anomalii ale funcţiei cognitive.
Zincul este un co-factor important al enzimelor implicate în detoxifierea amoniului (glutamin-sintetaza și ornitin-transcarbamilaza); de aceea, administrarea de suplimente de zinc poate ameliora statusul cognitiv și testele psihometrice la pacienţii cu EH. Diselectrolitemia (în particular hiponatremia, hipomagneziemia și hipocalcemia) poate determina alterarea statusului mental și precipita EH, și necesită, de aceea, corecţie promptă.

Administrarea de BCAA (valină, leucină, isoleucină) reprezintă o altă strategie de prevenire a catabolismului proteic și de reducere a hiperamoniemiei la pacienţii cu EH. Acești aminoacizi esenţiali sunt utilizaţi de mușchiul striat pentru amidarea glutaminei, proces asociat cu detoxifierea amoniului. Insuficienţa hepatică, șunturile porto-sistemice, sarcopenia, hiperinsulinemia și hiperglucagonemia determină reducerea BCAA și creșterea aminiacizilor aromatici (AAA) – fenilalanină, tirozină, triptofan – al căror influx în SNC produce un dezechilibru al neurotransmiţătorilor și precipită EH.
Administrarea orală îndelungată de BCAA se asociază cu creșterea detoxifierii amoniului și ameliorarea EH, stimulează regenerarea hepatică și sinteza proteinelor musculare, corectează dezechilibrul BCAA/AAA și ameliorează neurotransmisia cerebrală. Unele studii demonstrează un efect pozitiv al administrării îndelungate asupra statusului nutriţional și supravieţuirii.
LOLA este o mixtură a doi aminoacizi endogeni, substrat al ciclului ureogenetic, cu potenţial de fixare a amoniului sub formă de uree sau glutamină. De aceea, suplimentele de LOLA reprezintă o strategie terapeutică adecvată pentru reducerea hiperamoniemiei din EH. Studii recente și metaanalize sugerează un posibil efect benefic al LOLA asupra mortalităţii prin EH comparativ cu placebo sau cu lipsa unei intervenţii.
Alte efecte benefice rezultate din studiile clinice (calitate moderată, număr limitat de pacienţi) constau în ameliorarea statusului mental și reducerea amoniului circulant. Metaanaliza de tip network a demonstrat că LOLA are eficienţă comparabilă sau superioară cu dizaharidele non-absorbabile sau probioticele în reducerea hiperamoniemiei, precum și eficienţă documentată în tratamentul EH secundare implantării șuntului transjugular intrahepatic porto-sistemic (TIPS).
Prebioticele reprezintă substraturi alimentare utilizate selectiv de microorganismele cu potenţial benefic ale gazdei, determinând modificări în compoziţia și activitatea microbiotei cu efect favorabil pentru starea de sănătate; probioticele sunt microorganisme vii care, ingerate, determină modificări ale microbiotei cu efect benefic pentru gazdă, iar sinbioticele reprezintă o combinaţie între pre- și probiotice.
Pre-, pro- și sinbioticele produc modificări benefice ale microbiotei, care, cel puţin în teorie, ameliorează EH ca urmare a efectelor specifice la nivel intestinal: reducerea bacteriilor patogene, scăderea pH-ul intestinal și reducerea absorbţiei amoniului, îmbunătăţirea statusului nutriţional al epiteliului și reducerea permeabilităţii intestinale, accelerarea tranzitului intestinal. Ca o consecinţă, aceste modificări reduc nivelul amoniului seric, nivelul citokinelor circulante, inflamaţia sistemică și stresul oxidativ.
Lactuloza, lactilolul, fructo- și galacto-oligozaharidele și fibrele alimentare fermentabile sunt cele mai frecvente prebiotice utilizate în acest scop. Deși efectul lor în ameliorarea statusului cognitiv la pacientul cu EH a fost evidenţiat în câteva studii nestandardizate, pe loturi mici de pacienţi, rolul lor rămâne să fie demonstrat, de aceea (cu excepţia lactulozei), prebioticele nu sunt recomandate în mod curent în ghidurile de bună practică.
Într-un sudiu-pilot care a inclus 25 de pacienţi cu CH și EH manifestă clinic randomizaţi să primească lactuloză vs. oligofructoză îmbogăţită cu inulină, nivelul amoniului seric, testele psihometrice și Stroop Testul au înregistrat o ameliorare semnificativ superioară în grupul care a primit oligofructoză îmbogăţită.
Probioticele au fost studiate în profilaxia primară și secundară a EH. Administrarea de probiotice timp de 3 luni s-a asociat cu reducerea amoniului în sângele arterial, îmbunătăţirea performanţelor cognitive documentate prin teste psihometrice și reducerea riscului de apariţie a OHE comparativ cu placebo. În profilaxia secundară, probioticele s-au dovedit la fel de eficiente ca lactuloza pentru prevenirea episoadelor recurente și a spitalizării.
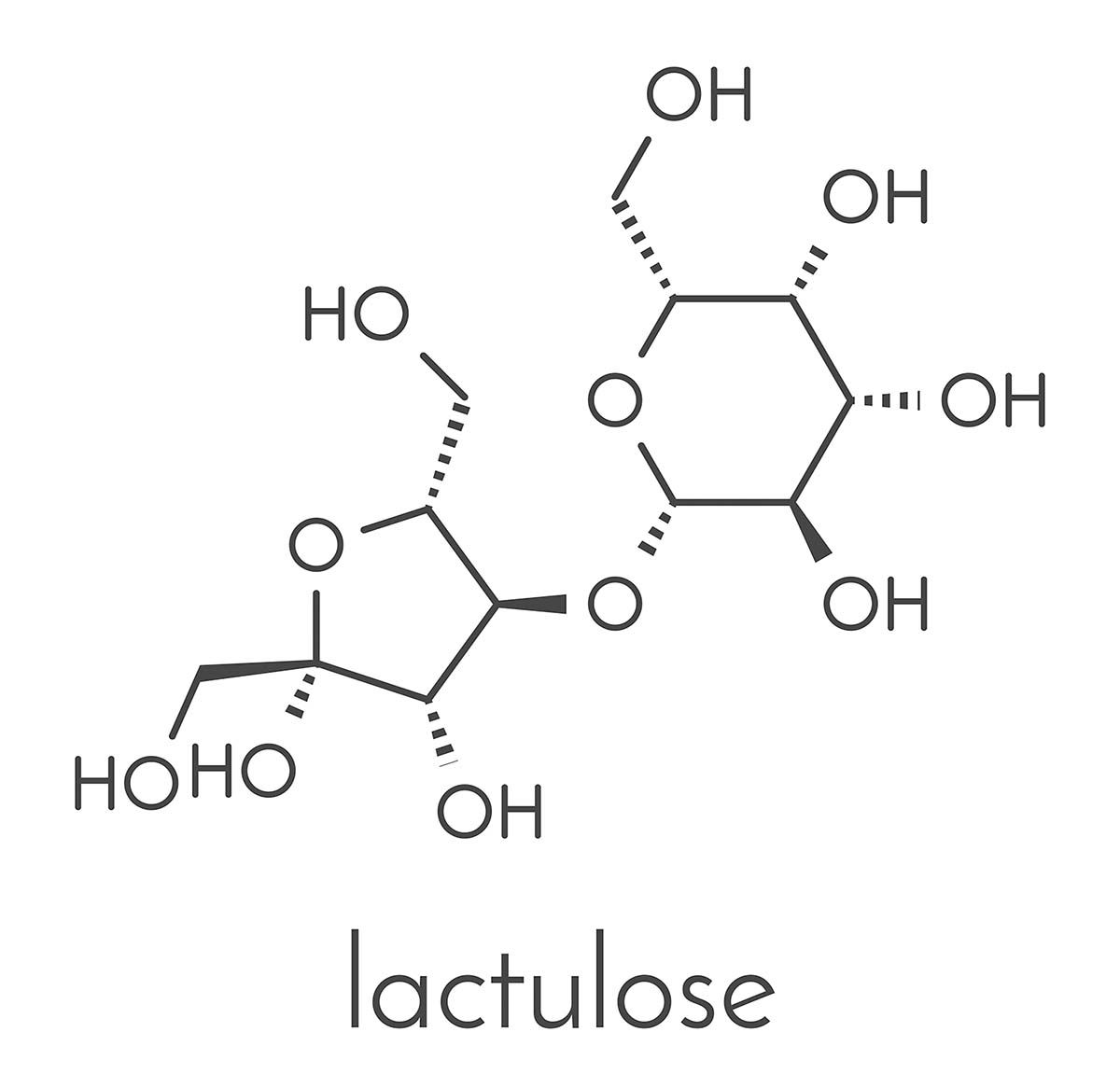
În momentul actual, dizaharidele non-absorbabile, lactuloza și lactilolul, reprezintă standardul terapeutic pentru OHE și profilaxia episoadelor secundare, recomandat de ghidurile societăţilor internaţionale. Aceste dizaharide de sinteză traversează intestinul fără a fi absorbite, sunt metabolizate parţial de către bacteriile colonice cu producere de acid lactic și acid acetic. Acidifierea mediului intestinal inhibă activitatea glutaminazelor bacteriene și producerea de amoniu și blochează absorbţia acestuia.
Adiţional, lactuloza și lactilolul acţionează ca prebiotice, favorizând dezvoltarea bacteriilor benefice fermentative (zaharolitice) ca Bifidobacterium, Lactobacillus și contracarând bacteriile generatoare de amoniac. În plus, s-a demonstrat că lactuloza reduce translocarea bacteriană, eliberarea de mediatori ai inflamaţiei și răspunsul inflamator sistemic.
Ghidurile internaţionale recomandă profilaxia secundară prin administrare de rifaximină la pacienţii care continuă să prezinte episoade de EH recurentă în ciuda administrării de dizaharide non-absorbabile.
Rifaximina este un antibiotic non-absorbabil a cărui eficacitate în reducerea amoniului seric, ameliorarea funcţiei cognitive, prevenirea spitalizărilor și reducerea recurenţelor a fost demonstrată în numeroase studii. Rifaximina acţionează printr-o serie de mecanisme: modularea microbiotei, reducerea amoniului circulant și translocării bacteriene, reducerea eliberării de endotoxine și citokine proinflamatorii, ameliorarea funcţiei de barieră intestinală.
Efectul administrării rifaximinei asupra axei intestin-ficat-creier a fost investigat într-un studiu pe 20 de pacienţi trataţi timp de opt săptămâni. Rifaximina a ameliorat performanţele cognitive ale pacienţilor prin modificarea compoziţiei (creșterea Eubacteriaceae și scăderea Veillonellaceae) și metabolismului bacterian. Efectul rifaximinei este amplificat de asocierea cu administrarea de lactuloză (reducerea spitalizării).
TMF reprezintă o nouă strategie de modulare a disbiozei din CH. Eficienţa iniţială a metodei a fost demonstrată în alte condiţii asociate cu disbioza și reducerea diversităţii bacteriene intestinale (infecţia cu Clostridiodes difficile, colita ulcerativă). Metoda constă în administrarea unei suspensii de fecale, de la un donator selecţionat, în tractul intestinal al receptorului, prin clisme, colonoscopie sau capsule. TMF duce la modificarea imediată a compoziţiei microbiotei, reinduce eubioza, cu reducerea inflamaţiei sistemice, restaurarea integrităţii mucosale și prevenirea translocării bacteriene.
Un studiu iniţial, deschis și randomizat, efectuat pe 20 de pacienţi cu EH recidivantă și MELD<17 trataţi cu lactuloză și rifaximină vs. TMF a demonstrat efecte pozitive de siguranţă, tolerabilitate și ameliorare a parametrilor clinici. Protocolul a constat în pretratament cu antibiotice cu spectru larg, urmat de o singură clismă cu materii fecale provenind de la un unic donator, selecţionat pe baza abundenţei de Lachnospiraceae și Ruminococcaceae, specii cu reprezentare intestinală redusă la pacienţii cu EH.
Numărul episoadelor de EH, spitalizările și efectele adverse severe au fost semnificativ reduse la pacienţii care au primit TMF. S-a observat o ameliorare cognitivă semnificativă evaluată prin teste psihometrice și EncephalApp Stroop Test. De asemenea, s-a observat o creștere a diversităţii bacteriene cu creșterea Ruminococcaceae și Bifidobacteriaceae și scăderea în Streptococcaceae și Veillonellaceae, asociate cu modificări metabolice (funcţionale) ca reducerea IL-6 și LPS-binding protein și creșterea de butirat/isobutirat (probabil prin creșterea abundenţei de Ruminococcaceae). Alte studii clinice cu TMF în EH se află în derulare.
Material preluat din volumul „Microbii din aparatul digestiv: dușmani și prieteni”, editat de Viaţa Medicală în 2021.
BIBLIOGRAFIE
1. Vilstrup HVA, Amodio P, Bajaj J, Cordoba J, Ferenci P, Mullen KD, et al.. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver. Hepatology 2014; 60: 715–735
2. Ridola L, Nardelli S, Gioia S, Riggio O. Quality of life in patients with minimal hepatic encephalopathy. World J Gastroenterol 2018; 24: 5446-5453
3. Bajaj JS, Wade JB, Sanyal AJ. Spectrum of neurocognitive impairment in cirrhosis: Implications for the assessment of hepatic encephalopathy. Hepatology 2009; 50: 2014-2021
4. Bajaj JS, Cordoba J, Mullen KD, Amodio P, Shawcross DL, Butterworth RF, Morgan MY; International Society for Hepatic Encephalopathy and Nitrogen Metabolism (ISHEN). Review article: the design of clinical trials in hepatic encephalopathy-an International Society for Hepatic Encephalopathy and Nitrogen Metabolism (ISHEN) consensus statement. Aliment Pharmacol Ther 2011; 33: 739-747
5. Patidar KR, Bajaj JS. Covert and Overt Hepatic Encephalopathy: Diagnosis and Management. Clin Gastroenterol Hepatol 2015; 13: 2048–2061
6. Allampati S and Mullen KD. Nomenclature and definition of hepatic encephalopathy — An update. Clinical Liver Disease 2015
7. International Society for Hepatic Encephalopathy and Nitrogen Metabolism (ISHEN). J Hepatol 2013;58(4):698–705
8. Shawcross DL, Dunk AA, Jalan R, Kircheis G, de Knegt RJ, Laleman W, Ramage JK, Wedemeyer H, Morgan IE; New Insights Steering Committee. How to diagnose and manage hepatic encephalopathy: a consensus statement on roles and responsibilities beyond the liver specialist. Eur J Gastroenterol Hepatol 2016; 28: 146-152
9. Ridola L, Cardinale V, Riggio O. The burden of minimal hepatic encephalopathy: from diagnosis to therapeutic strategies. Ann Gastroenterol 2018; 31: 151-164
10. Jepsen P, Ott P, Andersen PK, Sorensen HT, Vilstrup H. Clinical course of alcoholic liver cirrhosis: a Danish population-based cohort study. Hepatology 2020 ; 51 (5) :1675-1682
11. Bajaj JS. The role of microbiota in hepatic encephalopathy. Gut Microbes 2014; 5: 397-403
12. Campion D, Giovo I, Ponzo P, Saracco GM, Balzola F, Alessandria C. Dietary approach and gut microbiota modulation for chronic hepatic encephalopathy in cirrhosis. World J Hepatol 2019; 11(6): 489-512
13. Albhaisi SA, Bajaj JS, Sanyal AJ. Role of gut microbiota in liver disease. Am J Physiol Gastrointest Liver Physiol 2019; 318: G84–G98, doi:10.1152/ajpgi.00118.2019.
14. Guarner F, Malagelada JR. Gut flora in health and disease. Lancet 2003; 361: 512-519. DOI: 10.1016/S0140-6736(03)12489-0
15. Lynch SV, Pedersen O. The Human Intestinal Microbiome in Health and Disease. N. Engl J Med 2016; 375: 2369-2379. DOI: 10.1056/NEJMra1600266
16. Bajaj JS, Heuman DM, Hylemon PB, Sanyal AJ, White MB, Monteith P, et al. Altered profile of human gut microbiome is associated with cirrhosis and its complications. J Hepatol 2014; 60: 940-947
17. Bajaj JS, Ridlon JM, Hylemon PB, Thacker LR, Heuman DM, Smith S, Sikaroodi M, Gillevet PM. Linkage of gut microbiome with cognition in hepatic encephalopathy. Am J Physiol Gastrointest Liver Physiol 2012; 302: G168-G175. DOI: 10.1152/ajpgi.00190.2011
18. Usami M, Miyoshi M, Yamashita H. Gut microbiota and host metabolism in liver cirrhosis. World J Gastroenterol 2015; 21: 11597-11608. DOI: 10.3748/wjg.v21.i41.11597
19. Bajaj JS, Hylemon PB, Ridlon JM, Heuman DM, Daita K, White MB, Monteith P, Noble NA, Sikaroodi M, Gillevet PM. Colonic mucosal microbiome differs from stool microbiome in cirrhosis and hepatic encephalopathy and is linked to cognition and inflammation. Am J Physiol Gastrointest Liver Physiol 2012; 303: G675-G685. 10.1152/ajpgi.00152.2012
20. Zhang Z, Zhai H, Geng J, Yu R, Ren H, Fan H, et al. Large-scale survey of gut microbiota associated with MHE Via 16S rRNA-based pyrosequencing. Am J Gastroenterol 2013; 108: 1601-1611. DOI: 10.1038/ajg.2013.221
21. Bajaj JS. The role of microbiota in hepatic encephalopathy. Gut Microbes 2014; 5: 397-403. DOI: 10.4161/gmic.28684
22. Bajaj JS, Betrapally NS, Hylemon PB, Heuman DM, Daita K, White MB, et al. Salivary microbiota reflects changes in gut microbiota in cirrhosis with hepatic encephalopathy. Hepatology 2015; 62: 1260-1271. DOI: 10.1002/hep.27819
23. Shah A, Shanahan E, Macdonald GA, Fletcher L, Ghasemi P, Morrison M, et al. Systematic Review and Meta-Analysis: Prevalence of Small Intestinal Bacterial Overgrowth in Chronic Liver Disease. Semin Liver Dis 2017; 37: 388-400. DOI: 10.1055/s-0037-1608832
24. Maslennikov R, Pavlov C, Ivashkin V. Small intestinal bacterial overgrowth in cirrhosis: systematic review and meta-analysis. Hepatol Int 2018; 12: 567-576. DOI: 10.1007/s12072-018-9898-2
25. Zhang Y, Feng Y, Cao B, Tian Q. The effect of small intestinal bacterial overgrowth on minimal hepatic encephalopathy in patients with cirrhosis. Arch Med Sci 2016; 12: 592-596. DOI: 10.5114/aoms.2015.55675
26. Fukui H, Wiest R. Changes of Intestinal Functions in Liver Cirrhosis. Inflamm Intest Dis 2016; 1: 24-40. DOI: 10.1159/000444436
27. Fujii T, Seki T, Maruoka M, Tanaka J, Kawashima Y, Watanabe T, et al. Lactulose-L- rhamnose intestinal permeability test in patients with liver cirrhosis. Hepatol Res 2001; 19: 158-169 [PMID: 11164740]
28. Zuckerman MJ, Menzies IS, Ho H, Gregory GG, Casner NA, Crane RS, et al. Assessment of intestinal permeability and absorption in cirrhotic patients with ascites using combined sugar probes. Dig Dis Sci 2004; 49: 621-626 [PMID: 15185867]
29. Nagpal R, Yadav H. Bacterial Translocation from the Gut to the Distant Organs: An Overview. Ann Nutr Metab 2017; 71: 11-16 [PMID: 28950279 DOI: 10.1159/000479918]
30. Muñoz L, Borrero MJ, Úbeda M, Conde E, Del Campo R, Rodríguez-Serrano M, et al. Intestinal Immune Dysregulation Driven by Dysbiosis Promotes Barrier Disruption and Bacterial Translocation in Rats With Cirrhosis. Hepatology 2018. DOI: 10.1002/hep.30349]
31. Bernardi M, Moreau R, Angeli P, Schnabl B, Arroyo V. Mechanisms of decompensation and organ failure in cirrhosis: From peripheral arterial vasodilation to systemic inflammation hypothesis. J Hepatol 2015; 63: 1272-1284. DOI: 10.1016/j.jhep.2015.07.004]
32. Piano S, Brocca A, Angeli P. Renal Function in Cirrhosis: A Critical Review of Available Tools. Semin Liver Dis 2018; 38: 230-241. DOI: 10.1055/s-0038-1661372]
33. 42 Shawcross DL, Davies NA, Williams R, Jalan R. Systemic inflammatory response exacerbates the neuropsychological effects of induced hyperammonemia in cirrhosis. J Hepatol 2004; 40: 247-254 [PMID: 14739095]
34. Cabrera-Pastor A, Llansola M, Montoliu C, Malaguarnera M, Balzano T, Taoro-Gonzalez L, García- García R, Mangas-Losada A, Izquierdo-Altarejos P, Arenas YM, Leone P, Felipo V. Peripheral inflammation induces neuroinflammation that alters neurotransmission and cognitive and motor function in hepatic encephalopathy: Underlying mechanisms and therapeutic implications. Acta Physiol 2019; 226: e13270. DOI: 10.1111/apha.13270]
35. Azhari H, Swain MG. Role of Peripheral Inflammation in Hepatic Encephalopathy. J Clin Exp Hepatol 2018; 8: 281-285. DOI: 10.1016/j.jceh.2018.06.008]
36. Lima LCD, Miranda AS, Ferreira RN, Rachid MA, Simões E Silva AC. Hepatic encephalopathy: Lessons from preclinical studies. World J Hepatol 2019; 11: 173-185 [PM
37. Parekh PJ, Balart LA. Ammonia and Its Role in the Pathogenesis of Hepatic Encephalopathy. Clin Liver Dis 2015; 19: 529-537. DOI: 10.1016/j.cld.2015.05.002]
38. Chang KV, Chen JD, Wu WT, Huang KC, Lin HY, Han DS. Is sarcopenia associated with hepatic encephalopathy in liver cirrhosis? A systematic review and meta-analysis. J Formos Med Assoc 2019; 118: 833-842. DOI: 10.1016/j.jfma.2018.09.011]
39. Baraldi M, Avallone R, Corsi L, Venturini I, Baraldi C, Zeneroli ML. Natural endogenous ligands for benzodiazepine receptors in hepatic encephalopathy. Metab Brain Dis 2009; 24: 81-93 [PMID: 19082698 DOI: 10.1007/s11011-008-9111-8]
40. European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu; European Association for the Study of the Liver. EASL Clinical Practice Guidelines on nutrition in chronic liver disease. J Hepatol 2019; 70: 172-193. DOI: 10.1016/j.jhep.2018.06.024]
41. Plauth M, Bernal W, Dasarathy S, Merli M, Plank LD, Schütz T, Bischoff SC. ESPEN guideline on clinical nutrition in liver disease. Clin Nutr 2019; 38: 485-521. DOI: 10.1016/j.clnu.2018.12.022]
42. Cordoba J, Lopez-Hellin J, Planas M, Sabine P, Sanpedro F, Castro F, et al. Normal protein diet for episodic hepatic encephalopathy: Results of a randomized study. J Hepatol 2004; 41: 38-44
43. Gheorghe L, Iacob R, Vadan R, Iacob S, Gheorghe C. Improving of hepatic encephalopathy usind a high-calorie, high-protein diet. Rom J Gastroenterol (J Gastrointestin Liver Dis) 2005; 14: 231-238
44. Amodio P, Bemeur C, Butterworth R, Cordoba J, Kato A, Montagnese S, Uribe M, Vilstrup H, Morgan MY. The nutritional management of hepatic encephalopathy in patients with cirrhosis: International Society for Hepatic Encephalopathy and Nitrogen Metabolism Consensus. Hepatology 2013; 58: 325-336. DOI: 10.1002/hep.26370]
45. Bianchi GP, Marchesini G, Fabbri A, Rondelli A, Bugianesi E, Zoli M, Pisi E. Vegetable versus animal protein diet in cirrhotic patients with chronic encephalopathy. A randomized cross-over comparison. J Intern Med 1993; 233: 385-392
46. Maharshi S, Sharma BC, Sachdeva S, Srivastava S, Sharma P. Efficacy of Nutritional Therapy for Patients With Cirrhosis and Minimal Hepatic Encephalopathy in a Randomized Trial. Clin Gastroenterol Hepatol 2016; 14: 454-460.e3; quiz e33. DOI: 10.1016/j.cgh.2015.09.028]
47. Metcalfe EL, Avenell A, Fraser A. Branched-chain amino acid supplementation in adults with cirrhosis and porto-systemic encephalopathy: systematic review. Clin Nutr 2014; 33: 958-965. DOI: 10.1016/j.clnu.2014.02.011]
48. Gluud LL, Dam G, Les I, Marchesini G, Borre M, Aagaard NK, Vilstrup H. Branched-chain amino acids for people with hepatic encephalopathy. Cochrane Database Syst Rev 2017; 5: CD001939. DOI: 10.1002/14651858.CD001939.pub4]
49. Goh ET, Stokes CS, Sidhu SS, Vilstrup H, Gluud LL, Morgan MY. L-ornithine L-aspartate for prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev 2018; 5: CD012410. DOI: 10.1002/14651858.CD012410.pub2]
50. Butterworth RF, Kircheis G, Hilger N, McPhail MJW. Efficacy of l-Ornithine l-Aspartate for the Treatment of Hepatic Encephalopathy and Hyperammonemia in Cirrhosis: Systematic Review and Meta- Analysis of Randomized Controlled Trials. J Clin Exp Hepatol 2018; 8: 301-313. DOI: 10.1016/j.jceh.2018.05.004]
51. Iacob S, Cerban R, Gheorghe L. Which oligosaccharide to use for minimal hepatic encephalopathy in liver cirrhosis patients – oligofructose enriched-inulin or lactulose? J Hepatol 2014:60(Suppl1):S223 (P462)
52. Lunia MK, Sharma BC, Sharma P, Sachdeva S, Srivastava S. Probiotics prevent hepatic encephalopathy in patients with cirrhosis: a randomized controlled trial. Clin Gastroenterol Hepatol 2014; 12: 1003-8.e1. DOI: 10.1016/j.cgh.2013.11.006]
53. Agrawal A, Sharma BC, Sharma P, Sarin SK. Secondary prophylaxis of hepatic encephalopathy in cirrhosis: an open-label, randomized controlled trial of lactulose, probiotics, and no therapy. Am J Gastroenterol 2012; 107: 1043-1050. DOI: 10.1038/ajg.2012.113]
54. Dhiman RK, Rana B, Agrawal S, Garg A, Chopra M, Thumburu KK, Khattri A, Malhotra S, Duseja A, Chawla YK. Probiotic VSL#3 reduces liver disease severity and hospitalization in patients with cirrhosis: a randomized, controlled trial. Gastroenterology 2014; 147: 1327-37.e3. DOI: 10.1053/j.gastro.2014.08.031]
55. Amodio P. Hepatic encephalopathy: Diagnosis and management. Liver Int 2018; 38: 966-975. DOI: 10.1111/liv.13752
56. Kimer N, Krag A, Møller S, Bendtsen F, Gluud LL. Systematic review with meta-analysis: the effects of rifaximin in hepatic encephalopathy. Aliment Pharmacol Ther 2014; 40: 123-132. DOI: 10.1111/apt.12803]
57. Hudson M, Schuchmann M. Long-term management of hepatic encephalopathy with lactulose and/or rifaximin: a review of the evidence. Eur J Gastroenterol Hepatol 2019; 31: 434-450. DOI: 10.1097/MEG.0000000000001311]
58. Kang SH, Lee YB, Lee JH, Nam JY, Chang Y, Cho H, et al. Rifaximin treatment is associated with reduced risk of cirrhotic complications and prolonged overall survival in patients experiencing hepatic encephalopathy. Aliment Pharmacol Ther 2017; 46: 845-855. DOI: 10.1111/apt.14275]
59. Bajaj JS, Heuman DM, Sanyal AJ, Hylemon PB, Sterling RK, Stravitz RT, et al. Modulation of the metabiome by rifaximin in patients with cirrhosis and minimal hepatic encephalopathy. PLoS One 2013; 8: e60042. DOI: 10.1371/journal.pone.0060042]
60. Bajaj JS, Kassam Z, Fagan A, et al. Fecal microbiota transplant from a rational stool donor improves hepatic encephalopathy: a randomized clinical trial. Hepatology. 2017 https://doi.org/10. 1002/hep.29306.
61. Ryu J, Rahimi RS, Leise MD. The Current Hepatic Encephalopathy Pipeline. J Clin Exp Hepatol 2020; https://doi.org/10.1016/j.jceh.2020.01.001
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe