Se înmulţesc observaţiile medicale privind diverse manifestări clinice și modificări paraclinice asociate infecţiei cu SARS-CoV-2, dar și la complexitatea perturbărilor fiziopatologice provocate.
Odată cu creșterea rapidă a numărului de cazuri de COVID-19 în lume, dar și cu existenţa unui număr tot mai mare de pacienţi care au trecut prin boală, se înmulţesc și observaţiile medicale publicate referitoare la diverse manifestări clinice și modificări paraclinice asociate infecţiei cu virusul SARS-CoV-2, precum și la complexitatea perturbărilor fiziopatologice provocate de acesta.
Coagulopatia instalată în cursul infecţiei cu virusul SARS-CoV-2 a apărut în scurt timp ca fiind unul dintre principalii factori implicaţi în patogeneza suferinţelor de organ răspunzătoare de manifestările clinice severe și critice, inclusiv decesul pacienţilor.
Cercetată intens în ultimele luni pentru a răspunde diverselor întrebări legate de aspecte clinice și de eficienţa tratamentelor, coagulopatia din COVID-19 a depășit nivelul unui „simplu și ocazional” sindrom de coagulare intravasculară diseminată (CID), cum a fost considerată la început.
În primul rând, deși incidenţa sa reală este dificil de evaluat din diversele raportări, această complicaţie a infecţiei cu virusul SARS-CoV-2 s-a dovedit a fi frecventă. Ea a fost evidenţiată, în diverse grade, la cca. 11,5-45% dintre cazurile cu forme non-severe și la cca. 30-70% dintre cei cu forme severe, sau la 71,4% dintre non-supravieţuitori.
Sunt afectate vasele mici și mari
Trombozele venoase, arteriale și embolice conexe sunt consecinţa stării de hipercoagulabilitate. Frecvenţa lor înregistrată în unităţile de terapie intensivă variază de la 9% la 70%, în funcţie de metodele de
diagnosticare a evenimentului trombotic și de gradul de utilizare a acestora, investigaţiile fiind grevate și de situaţia critică a pacienţilor.
Ele s-au asociat în mod independent cu o rată ridicată a severităţii
COVID-19 și a mortalităţii, examinările postmortem arătând depozite de tip trombotic în vasele mici din plămâni și din alte organe. O caracteristică a complicaţiilor trombotice din COVID-19 o reprezintă afectarea arterelor mari, precum arterele cerebrale și ale membrelor inferioare, ce se întâlnește și pacienţi tineri.
De menţionat că multe dintre complicaţiile trombotice au survenit la pacienţii aflaţi în compartimentele de urgenţă la care se instituise tratamentul anticoagulant profilactic standard recomandat, ceea ce arată că acest tratament este eficace în primul rând sau numai la cazurile cu severitate medie. De altfel, se conturează un profil clinicobiologic și evolutiv trombotic distinct al pacienţilor admiși în unităţile de terapie intensivă pentru COVID-19.
Trombozele survin semnificativ mai frecvent în COVID-19 decât în alte infecţii virale, precum pandemia de gripă din 2009, de exemplu, unde prevalenţa trombozelor evidenţiate a fost de numai cca. 6%, iar histologic s-a constatat o frecvenţă mult mai mică a microangiopatiei și a microtrombilor în capilarele alveolare la cei decedaţi cu insuficienţă respiratorie acută.
Evoluţia D-dimerilor și a timpului de protrombină
S-a constatat o corelaţie între nivelurile D-dimerilor de ≥1mg/L la internare și riscul crescut de instalare a sindromului de suferinţă respiratorie acută și deces. Un prag al D-dimerilor ≥2 mg/L la internare a indicat decesul pacientului cu o sensibilitate de 92,3% și o specificitate de 83,3%.
De asemenea, creșteri spontane ale timpului de protrombină cu >3 secunde și ale timpului de tromboplastină parţială activată cu >5 secunde s-au dovedit a fi factori independenţi în prezicerea complicaţiilor tromboembolice.
Astfel, coagulopatia joacă un rol important, dacă nu preponderent, în producerea acestui sindrom și a altor suferinţe de organ constatate la pacienţii cu forme severe de COVID-19.
În plus, în afara valorilor ridicate ale D-dimerilor și ale timpului de protrombină la internare, creșterea acestora în dinamică, de regulă în zilele 10-14 de la începutul spitalizării, constituie un indicator important pentru evoluţia spre o formă severă, cu trecerea spre faza critică și deces.
În esenţă, modificările testelor de coagulare asociate COVID-19 indică atât instalarea, cât și persistenţa și progresia unei stări de hipercoagulabilitate. Aceasta, împreună cu alţi factori, precum imobilizarea prelungită, hipoxia, deshidratarea, afectarea vasculară, cateterizările venoase prelungite, crește substanţial riscul trombozelor, manifeste sau nu clinic, și implicit al determinărilor tromboembolice, îndeosebi pulmonare.
Astfel, este favorizat sau agravat sindromul de suferinţă respiratorie acută, consecinţă a afectării alveolare induse de virus. La starea de hipercoagulabilitate asociată COVID-19 se adaugă și variabile precum: vârsta >65 de ani, sexul masculin, boala arterială coronariană și infarctul miocardic în antecedente, care s-au asociat semnificativ statistic mai frecvent cu evenimentele trombotice din cursul COVID-19.
Au fost identificate două vârfuri ale incidenţei evenimentelor tromboembolice, unul iniţial, începând la cca. 4 zile de la internare, consecinţă în principal a perturbărilor tromboinflamatorii, și un al doilea după cca. 3-4 săptămâni, consecinţă a asocierii în diverse grade a celorlalţi factori (Fig. 1).
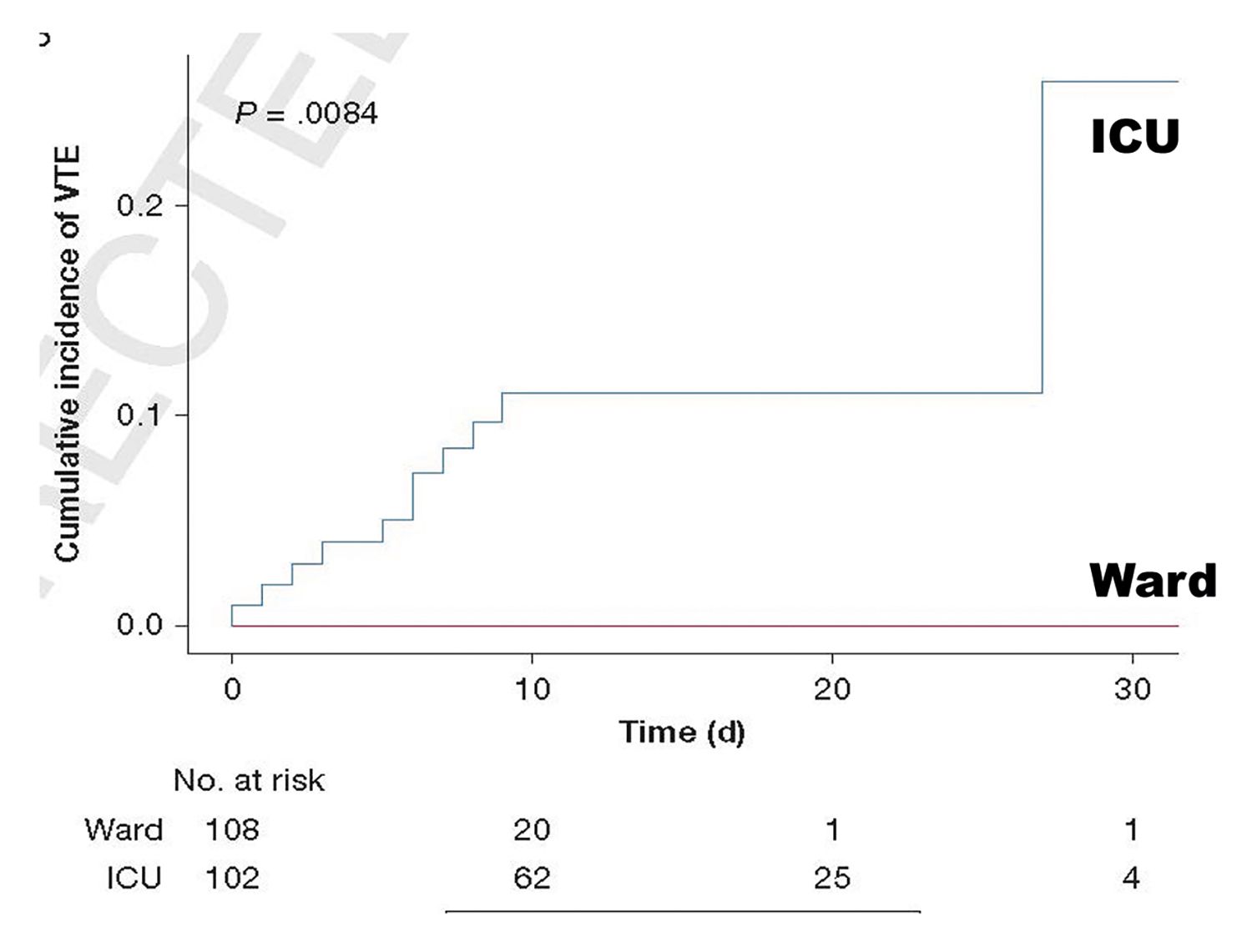
Fiziopatologie
În al doilea rând, coagulopatia din infecţia cu SARS-CoV-2 apare diferită atât de sindromul de CID clasic, cât și de microangiopatia trombotică, precum și de coagulopatia întâlnită în sindromul septic microbian. Deși depozitele trombotice din plămâni sunt bogate în trombocite și chiar în megacariocite, trombocitopenia este moderată și inconstantă, iar semnele de hemoliză microangiopatică lipsesc.
De asemenea, nivelul sanguin al D-dimerilor este la valori mult mai mari decât cele întâlnite în sindromul de CID comun din alte infecţii. Mai mult, coagulopatia asociată COVID-19 nu evoluează ca o coagulopatie de consum, spre sindrom hemoragic, manifestările hemoragice fiind rareori întâlnite pe parcursul evoluţiei, și doar în fazele terminale.
Spre deosebire de infecţia cu alte virusuri ARN, precum Ebola sau alte febre hemoragice, infecţia cu SARS-CoV-2 nu se complică cu sângerări semnificative. Coagulopatia din COVID-19 s-a dovedit a fi diferită atât de cea asociată sepsisului, cât și de cea asociată purpurei trombotice trombocitopenice/sindromului hemolitic uremic sau cancerului.
Datele existente până în prezent sugerează că coagulopatia asociată COVID-19 este mai degrabă o combinaţie între un sindrom de CID de grad mic și o microangiopatie trombotică localizată predominant în plămâni, dar cu potenţial de extindere și în alte organe. Aceasta se conturează ca o posibilă entitate distinctă în cadrul tulburărilor de coagulare trombotice dobândite descrise până în prezent.
Coagulopatia din COVID-19 nu este consecinţa acţiunii directe a virusului SARS-CoV-2, deși a fost avansată ipoteza unei afectări directe a celulelor endoteliale vasculare care au pe membrană receptorul pentru ACE2, de care se fixează virusul. Se consideră că ea este mai degrabă consecinţa sindromului inflamator cu producere de citokine proinflamatorii declanșat de acesta, care determină activarea sistemului de coagulare și generarea trombinei.
Simultan au loc supresia căilor anticoagulante endogene, dar și activarea sistemului fibrinolitic (concentraţii plasmatice semnificativ crescute de activator tisular al plasminogenului – t-PA), ca urmare a afectării endoteliale a microcirculaţiei, mediată de citokine.
Aceasta ar explica nivelurile ridicate ale D-dimerilor și produșilor de degradare ai fibrinei întâlnite la pacienţii cu COVID-19. Activarea trombocitelor, creșterea nivelului de factor vonWillebrand, activarea căii extrinseci tisulare, creșterea radicalilor liberi oxidanţi sunt alţi factori incriminaţi în producerea coagulopatiei (Fig. 2).
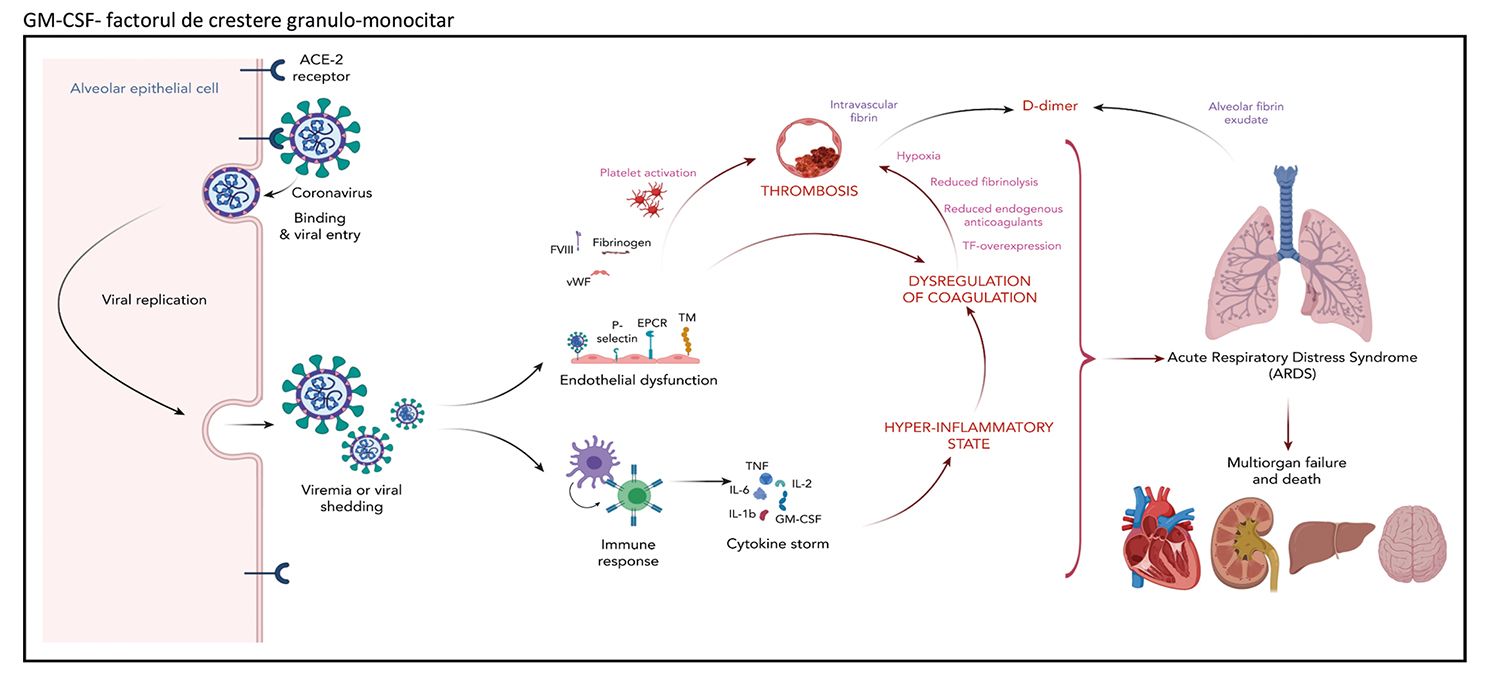
Au fost elaboraţi mai mulţi algoritmi de laborator pentru stratificarea pacienţilor cu COVID-19, în funcţie de categoria de risc, folosindu-se combinaţii de diverși parametri hematologici, biochimici și inflamatori (o sinteză a acestor parametri este prezentată în tabelul 1), utilizându-se testele din practica curentă. Cel mai util test se dovedește a fi nivelul D-dimerilor.
În concluzie, coagulopatia asociată COVID-19 este o complicaţie frecvent întâlnită în această boală, dar numai la pacienţii cu forme
medii-severe și severe, ce nu depășesc de regulă cca. 20-30% dintre cei infectaţi. Ea determină o stare de hipercoagulabilitate ce predispune la tromboze venoase și arteriale atât în micro-, cât și în macrocirculaţie.
Coagulopatia fiind declanșată în principal de răspunsul imun al gazdei, manifestările ei clinice au o patogeneză complexă („imunotromboză”) și, nu rareori, un comportament atipic și răspuns terapeutic variabil.
Sunt necesare trialuri randomizate (în curs) pentru a preciza indicaţiile, mijloacele optime de tratament profilactic și terapeutic și intensitatea tratamentului anticoagulant, cu păstrarea echilibrului între coagulare și sângerare, și pentru a se vedea dacă anticoagularea împiedică cu adevărat progresia suferinţelor de organ, odată instalate.
Astăzi, COVID-19 este considerată o boală infecţioasă inflamatorie acută. Au fost identificate până în prezent cel puţin două categorii de afecţiuni cu mecanism de producere imunologic-inflamator conexe acesteia, și anume: una în care predomină elementele intens inflamatorii, precum sindromul inflamator multisistemic pediatric, care include mai multe subentităţi cu diverse denumiri – boala Kawasaki-like, sindromul cu șoc tip boala Kawasaki, sindromul de activare a macrofagelor cu șoc și miocardită, și o alta în care predomină elementele de autoimunitate.
Deoarece manifestările clinicobiologice sunt în genere diferite, iar interrelaţiile patogenice dintre cele două categorii sunt încă neclare (mecanisme autoinflamatorii), ne vom limita în acest material la afecţiunile asociate infecţiei cu virusul SARS-CoV-2 care au mecanismul de producere autoimun recunoscut.
Manifestări acute
Este un fapt dovedit că virusurile pot avea un rol important, alături probabil și de alţi factori: genetici, imunologici ș.a., în apariţia unor boli autoimune. Supravieţuitori ai unor infecţii virale, precum gripa, Ebola, Zika, hepatita cu virus C, febra Chikungunya, herpes, sindromul respirator din Orientul Mijlociu (MERS) și altele, s-au confruntat fie cu apariţia de boli autoimune în cursul evoluţiei ori în săptămânile sau lunile de după vindecarea virozei, fie cu prezenţa îndelungată a unor limfocite autoreactive sau/și a diverșilor autoanticorpi.
Referitor la infecţia cu virusul SARS-CoV-2, au fost publicate câteva cazuri la care boala autoimună a apărut în cursul evoluţiei COVID-19. Au fost raportate opt cazuri de anemie hemolitică autoimună (AHAI), atât cu anticorpi la cald (cinci cazuri), cât și cu anticorpi la rece, două cazuri cu purpură trombocitopenică imună (unul pediatric), șase cu poliradiculonevrită (sindrom Guillain-Barré și Miller-Fischer), trei cazuri de sindrom antifosfolipidic, un caz cu miastenie gravis.
Toate aceste cazuri au survenit în cursul evoluţiei COVID-19. Majoritatea acestor pacienţi aveau vârsta >60 de ani, au avut forme severe de viroză, fenomenul autoimun manifestându-se, în genere, în primele 10 zile de la debutul infecţiei. De menţionat că un pacient avea o tiroidită autoimună preexistentă, iar cinci pacienţi cu AHAI aveau modificări hematologice sugestive pentru limfoproliferări cronice (afecţiuni recunoscute pentru asocierea frecventă cu hemocitopenii autoimune).
Cazurile au fost sporadice și s-au manifestat sub formă acută, evoluând în ansamblu favorabil sub tratamentul specific uzual. Nu se cunoaște evoluţia acestor manifestări autoimune în timp, astfel că nu se poate preciza dacă ele au devenit boli autoimune cronice de sine
stătătoare.
Modificările umorale sugestive pentru un proces autoimun au fost însă mai frecvente: testul antiglobulinic (Coombs) direct a fost pozitiv la 46% dintre pacienţii cu COVID-19 spitalizaţi (faţă de numai 1-15% pozitivitate la pacienţi spitalizaţi pentru alte boli acute), anticorpii antinucleari la ~35%, anticoagulantul lupic la 11-35,5% dintre pacienţii infectaţi cu virusul SARS-CoV-2 (la 80-90% dintre cei cu aPTT prelungit).
Mimetism molecular
Infecţia cu virusul SARS-CoV-2 se asociază cu dereglări imunoinflamatorii importante, care constituie o particularitate a acesteia comparativ cu alte infecţii virale, dereglări în care și mecanisme autoimune par a fi amorsate.
Nu se poate spune încă dacă acest virus este un „trigger” per se al unei boli autoimune de novo sau/și un factor de activare/reactivare a unei stări autoimune anterioare subclinice.
Frecvenţa redusă a asocierii temporale a bolilor autoimune cu COVID-19, apariţia timpurie în cursul evoluţiei COVID-19 indică faptul că această asociere ar putea fi doar o coincidenţă, și nu cauza. Astfel, faptul că infecţia cu virusul SARS-CoV-2 induce boli autoimune acute sau/și cronice rămâne deocamdată incert.
S-a susţinut că iniţierea unui proces autoimun ar avea loc în fazele de început ale virozei, el contribuind la complexitatea patogenezei leziunilor tisulare din COVID-19. Ar avea loc o agravare a leziunilor de organ prin mecanisme de tip autoimun, precum, de exemplu, cel al „mimetismului molecular” sau al „martorului inocent” (Figura).
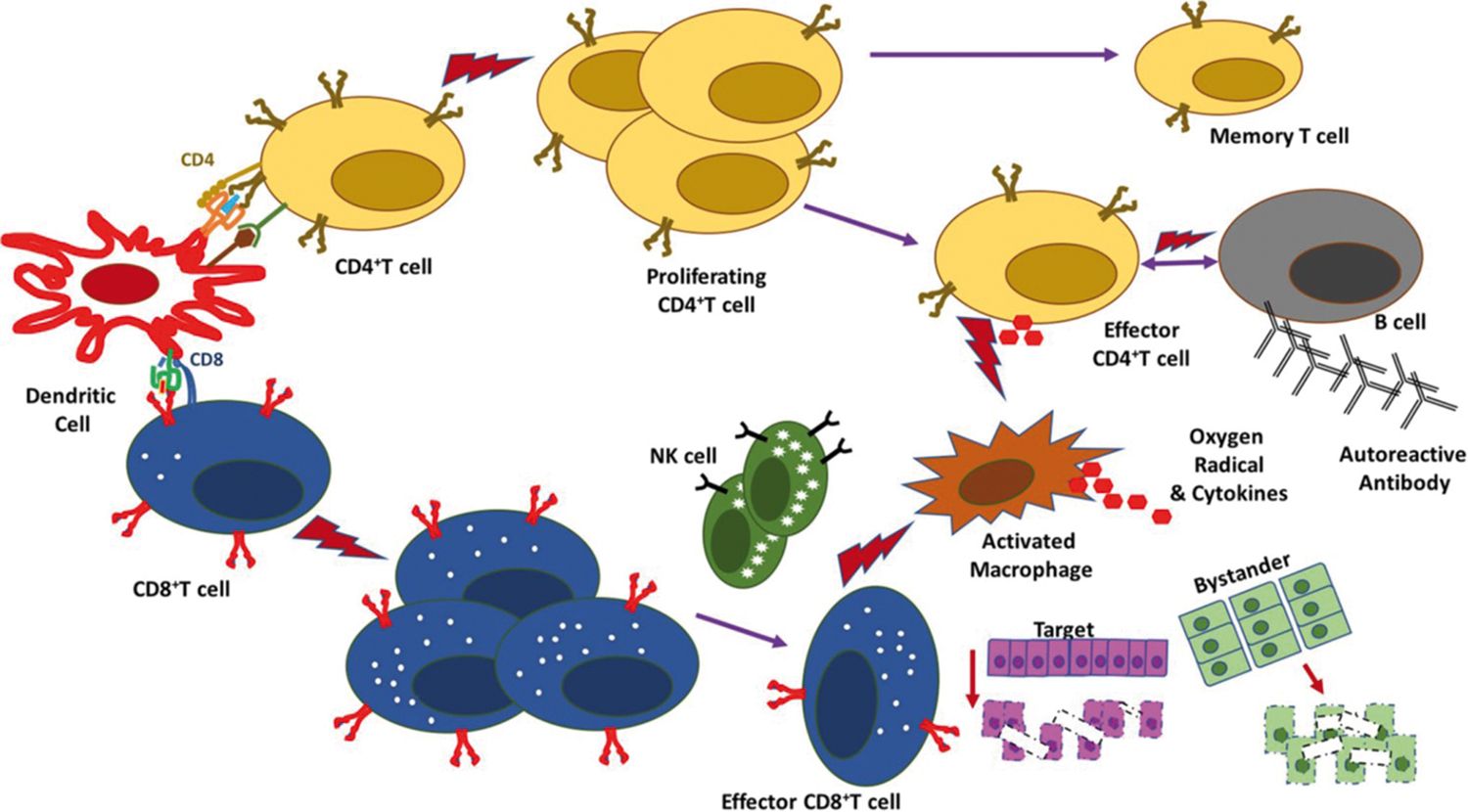
Ipoteza este susţinută de constatări histopatologice necroptice, precum infiltrarea difuză a plămânilor și infiltrarea focală a altor organe cu limfocite T activate, predominant CD8, unele dintre ele autoreactive. Acestea realizează o „buclă de amplificare” în cadrul procesului inflamator al furtunii de citokine, atât de caracteristic formelor severe de COVID-19.
Concluzie
Datele acumulate până în prezent nu confirmă existenţa unei legături cauzale între infecţia cu virusul SARS-CoV-2 și apariţia unor boli autoimune recunoscute ca atare. Asocierea temporală, infiltrarea difuză și focală cu limfocite T din constatările histopatologice necroptice și prezenţa autoanticorpilor în serul unui număr semnificativ de pacienţi infectaţi cu SARS-CoV-2 sunt singurele argumente, indirecte, pentru o legătură cauzală între cele două entităţi clinice, dar cercetările în domeniu continuă, implicând discipline variate.
Trecerea în revistă a asocierilor bolilor autoimune cu COVID-19 are implicaţii practice pentru diagnostic și mod de abordare, deoarece unele dintre simptomele de debut ale acestei viroze sunt asemănătoare cu cele ale unor boli autoimune (febră, artralgii, dureri de tip miozitic, erupţii cutanate ș.a.), iar existenţa autoanticorpilor în ser trebuie interpretată judicios. Posibilitatea existenţei unui mimetism molecular și a unei reactivităţi încrucișate consecutive între antigene virale și tisulare umane trebuie avută în vedere și în cercetările privind producerea unui vaccin anti-SARS-CoV-2.
* Bibliografie
1. Terpos E. et al. Hematological findings and complications of COVID-19. Am J Hematol. 2020;95:834–847.
2. Levi M. et al. Coagulation abnormalities and thrombosis în patients with COVID-19. Lancet Haematol 2020, https://doi.org/10.1016/S2352-3026(20)30145-9
3. Connors J. M., Levy J.H. COVID-19 and its implications for thrombosis and anticoagulation. Blood. 2020;135(23):2033
4. Violi F., et al. Hypoalbuminemia, Coagulopathy and Vascular Disease în Covid-19. Circulation Research. 2020;127:400–401
5. Bilaloglu S. et al. Thrombosis în Hospitalized PatientsWith COVID-19 în a NewYork City Health System. JAMA 2020, doi:10.1001/jama.2020.13372
6. Levi M. et al. Coagulation abnormalities and thrombosis în patients with COVID-19. Lancet Hematology 2020, 7:e440, doi.org/10.1016/S2352-3026(20)30145-9
7. Ka Man Cheung C. et al. Coronavirus Disease 2019 (COVID-19): A Haematologist’s perspective. Acta Haematol 2020, DOI: 10.1159/000510178
8. Fogarty H. et al. More on COVID-19 coagulopathy în Caucasian patients. Br J Haematol. 2020, doi. 10.1111/bjh.16791
9. Al-Samkari H, et al. COVID and coagulation: Bleeding and thrombotic manifestations of SARS-CoV2 infection. Blood. 2020,
10. Moll M. et al. VTE în ICU patients with COVID-19. Chest 2020, 5 August (in press)
11 Lee A., Baumann-Kreuzinger L. The COVID Coagulopathy Conundrum: Facts, Fiction, and Fantasy. The Hematologist (ASH) 2020, 17(4):4
12. de Oliveira Toledo S.L. et al. COVID-19: review and hematologic impact. Clinica Chimica Acta 2020, 510:170, doi.org/10.1016/j.cca.2020.07.016
13. Rapkiewicz A.V. et al. Megakaryocytes and platelet-fibrin thrombi characterize multi-organ thrombosis at autopsy în COVID-19: A case series. EClinicalMedicine (2020), https://doi.org/10.1016/j.eclinm.2020.100434
**Bibliografie
1. Shah S. et al. Autoimmune and rheumatic musculoskeletal diseases as a consequence of SARS‑CoV‑2 infection and its treatment. Rheumatology International 2020, doi.org/10.1007/s00296-020-04639-9
2. Lazarian G. et al. Autoimmune haemolytic anaemia associated with COVID-19 infection. Brit J Haematol, 2020, 190(1):29–31
3. Lopez C. et al. Simultaneous onset of COVID-19 and autoimmune haemolytic anaemia. Brit J Haematol, 2020, 190 (1):31-32, doi: 10.1111/bjh.16786
4. Hendrickson J. E., Tormey C A. COVID-19 and the Coombs test. Blood 2020, 136(6):655
5. Berzuini A, et al. Red cell–bound antibodies and transfusion requirements in hospitalized patients with COVID-19. Blood. 2020;136(6):766.
6. Zulfiqar A.‑A., et al Immune thrombocytopenic purpura in a patient with Covid-19. NEJM 2020, DOI: 10.1056/NEJMc2010472
7. Gazzaruso C. et al. High prevalence of antinuclear antibodies and lupus anticoagulant in patients hospitalized for SARS-CoV2 pneumonia. Clinical Rheumatology 2020, 39:2095–2097
8. Alberti P. et al. Guillain-Barre syndrome related to COVID-19 infection. Neurol Neuroimmunol Neuroinflamm 2020,7:e741. doi:10.1212/NXI.0000000000000741
9. Toscano G. et al. Guillain–Barré Syndrome Associated with SARS-CoV-2.N Engl J Med 2020,382:26
10. Ehrenfeld M. et al. Covid-19 and autoimmunity. Autoimmunity Reviews 2020,19,(8):1, doi.org/10.1016/j.autrev.2020.102597
11. Tsao Hoi See et al. Immune thrombocytopenia (ITP) în a pediatric patient positive for SARS-CoV-2. Pediatrics 2020,146(2): e20201419, doi.org/10.1542/peds.2020-1419
12. Lyons-Weiler J. Pathogenic priming likely contributes to serious and critical illness and mortality în COVID-19 via autoimmunity. Journal of Translational Autoimmunity 2020, doi.org/10.1016/j.jtauto.2020.100051
13. Restivo D.A. et al. Myasthenia Gravis associated with SARS-CoV-2 infection. An Int Med 2020, doi.org/10.7326/L20-0845
14. Galeotti C., Bayry J. Nature Reviews | Rheumatology 2020, doi.org/10.1038/s41584-020-0448-7
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe