Între ideea riscului colonizării bacteriene
pentru declanşarea, exacerbarea şi severitatea astmului bronşic, pe de o parte,
şi ideea infecţiilor bacteriene protectoare, există un echilibru precar şi mult
discutat. Recent, se sugerează că infecţia cu H. pylori protejează faţă de astmul bronşic. Este spectaculoasă
această afirmaţie pentru o bacterie care, pentru stomac, are risc cancerigen
bine cunoscut, dar în acelaşi timp pentru plămân este benefică. Arnold a
demonstrat că, la copiii infectaţi cu H.
pylori, riscul pentru astm bronşic a diminuat cu 40–60% faţă de cei
neinfectaţi. Datele care sprijină această supoziţie arată că expunerea la
alergeni a fost inofensivă la cei cu H.
pylori, în comparaţie cu un grup de control, efect care a dispărut după
eradicarea bacteriană. Celulele T reglatoare se acumulează în plămânul subiecţilor
infectaţi şi astfel influenţează benefic răspunsul alergic. Celulele T
reglatorii pot acţiona prin migrare de la o suprafaţă mucoasă la alta (în cazul
acesta, de la stomac la plămân) şi, astfel, bacteria intragastrică, prin reacţiile
inflamatorii declanşate, influenţează benefic, din perspectiva astmului,
întregul răspuns imun sistemic (14).
Legăturile plămânului cu alte teritorii
epiteliale au fost mult dezbătute în ultima perioadă, în special în astmul bronşic,
prin faptul că s-a constatat că există bacterii care colonizează plămânul în
zonele în care a fost considerat întotdeauna steril. În plină evoluţie a
teoriei igienei, Bisgaard susţine recent că sugarii care prezintă infecţii
pulmonare cu bacterii patogene imediat după naştere au risc mult mai mare pentru
astm bronşic. Plămânii adulţilor astmatici conţin mult mai multe bacterii decât
plămânii persoanelor fără astm. Pacienţii cu exacerbări uşoare ale bolii au o
colonizare bacteriană mult mai mică faţă de cei care au dezvoltat forme severe
de astm.
La om, microbiota intestinală cântăreşte 1
kg şi este reprezentată prin peste 10.000 de miliarde de bacterii, din peste
1.000 de specii diferite. Influenţa acestor bacterii este mult mai profundă
decât simpla competiţie de a ne apăra de germeni patogeni la nivel digestiv.
Modularea nutriţională a inflamaţiei este dublată de modularea imună protejată
prin microbiota intestinală într-o serie întreagă de stări patologice.
Elucidarea încă parţială a acestor mecanisme menţine în interesul cercetătorilor
subiectul. Există noi frontiere care trebuie elucidate în scopul precizării
riscurilor infecţiei şi beneficiului profilaxiei şi tratamentului infecţiei.
Se reafirmă ideea că arborele bronşic nu
este steril, conţinând o medie de 2.000 de genomuri bacteriene pe cm2 de
suprafaţă. Această ipoteză de lucru creează speranţe că modularea microbiomului
respirator ar putea fi cheia victoriei într-un război atât de lung, fiindcă
astmul nu are deocamdată un tratament curativ. Echilibrul bacterian reprezintă
un ghid pentru a afirma riscul sau protecţia pentru boală, dezechilibrul
acestuia fiind principala verigă în apariţia şi agravarea bolii.
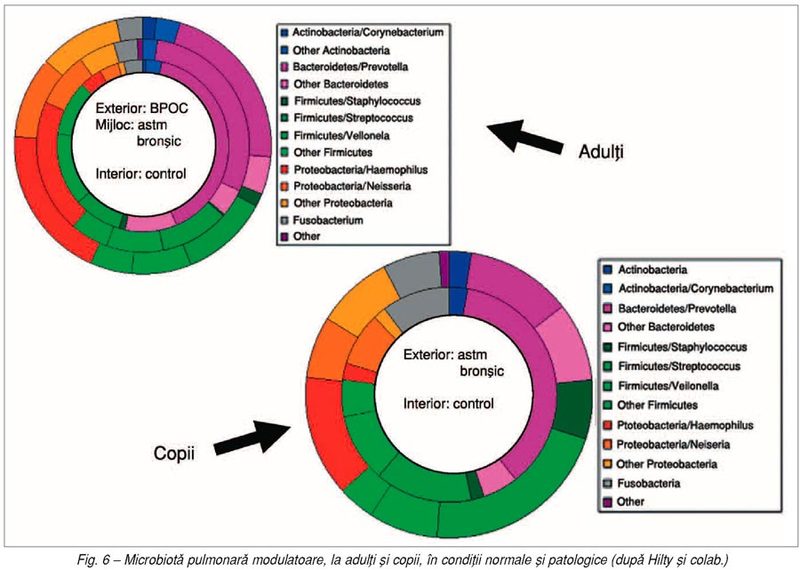
Un studiu recent al unui grup internaţional
de cercetători compară variaţiile microbiotei căilor aeriene la pacienţi adulţi
normali, cu astm bronşic şi cu bronhopneumopatie obstructivă cronică, dar şi la
copii astmatici şi sănătoşi. Au fost puse în evidenţă 5.054 de secvenţe
bacteriene de ARN ribozomal 16S la cei 43 de subiecţi luaţi în studiu,
identificându-se peste 70% din speciile existente (fig. 6) (15).
Revoluţia afirmaţiilor îşi are originea în
noile posibilităţi de investigare. Doar 1% din toate bacteriile pot fi
cultivate în laborator, astfel încât cultura nu mai este standardul de aur
pentru diagnosticul infecţiilor. Metode independente de cultură, pe baze
moleculare, au demonstrat că microbiomul uman este mult mai vast decât a fost
descris până acum. Relaţiile de simbioză cu flora bacteriană sunt esenţiale
pentru menţinerea stării de sănătate. Modificările microecosistemului duc la
perturbarea acestei simbioze şi apariţia sau exacerbarea unor boli cronice.
Analiza ARN ribozomal 16S la pacienţi sănătoşi a arătat prezenţa majoritară a
actinobacteriilor (în special Corynebacteriumspp.) şi a bacteriilor din genul Firmicutes (Staphylococcus spp.) la
nivel nazal. Bacteroidetes (în
special Prevotella) au fost regasite
în orofaringe, iar Haemophilus spp. a prevalat la nivel pulmonar,
comparativ cu alte sedii aeriene. În plus, Prevotella
modulează producţia de citokine induse de Haemophilus.
Astmul şi BPOC asociate bacteriilor patogene
produc cantităţi de trei-cinci ori mai mari de IL-23, IL-12 şi IL-10,
comparativ cu cele produse de bacteriile comensale. Pe baza diferenţelor
profilurilor citokinice, bacteriile au efecte proinflamatorii asupra celulelor
dendritice, modulând astfel microbiota pulmonară.
Noile metode de identificare a profilurilor
bacteriologice ale căilor aeriene utilizează tehnici moleculare de punere în
evidenţă a ARN ribozomal tip 16S. Deşi infecţiile bacteriene sunt implicate în
aproape jumătate din exacerbările astmatice, recent sunt caracterizaţi o serie
de agenţi patogeni, identificaţi primar prin metodele clasice (cultura
produselor biologice recoltate din diverse etaje ale arborelui respirator şi în
diferite patologii) şi apoi confirmaţi prin evidenţierea ARN ribozomal
bacterian. Aceasta din urmă oferă o specificitate de identificare net superioară
metodelor clasice, contribuind cu succes la caracterizarea complexă a
microbiomului pulmonar.
Un colectiv de autori din SUA a identificat
peste 1.200 de specii bacteriene din 140 de familii distincte în arborele
respirator al pacienţilor cu BPOC. Surprinzător este faptul că multe dintre
aceste specii nici nu fuseseră anterior descrise în patologia respiratorie, prezenţa
lor fiind legată şi de exacerbări infecţioase acute, dar şi de durata
perioadelor de intubaţie. Se consideră că sunt 75 de specii bacteriene de bază,
existente ubicuitar atât la pacienţii cu BPOC, cât şi la loturile de control,
majoritatea patogeni cunoscuţi şi descrişi. Plecând de la acest tablou iniţial,
variaţia microbiomului este determinată de severitatea exacerbărilor
respiratorii, necesitatea suportului ventilator şi durata de intubare, dar şi
de administrarea antibioticelor, unele specii fiind puse în evidenţă doar în
momentul administrării antibioticoterapiei.
Metodă de înaltă rezoluţie, ce nu necesită
cultură, identificarea ARN ribozomal 16S a permis recunoaşterea unor
reprezentanţi ai familiilor Pseudomonadaceae,
Enterobacteriaceae, Helicobacteriaceae, alături de patogenii cunoscuţi – H. influenzae şi P. aeruginosa, implicaţi în exacerbările bolilor pulmonare cronice.
Migrarea bacteriană se realizează în ambele sensuri, în cadrul aparatului
respirator (căi aeriene superioare – căi aeriene inferioare şi invers), dar au
fost regăsite specii bacteriene specific digestive (H. Cetorum, C. mucosalis) în
compoziţia microbiotei respiratorii. Mai mult, prezenţa florei orofaringiene
sau digestive la nivelul căilor aeriene inferioare a fost asociată cu un risc
mai mare de exacerbare infecţioasă.
Identificarea relaţiilor dintre speciile
bacteriene, expresia lor genomică, răspunsul imun al gazdei şi particularităţile
clinico-evolutive individuale – toate acestea sunt elemente ce vor duce la înţelegerea
patogeniei bolilor pulmonare cronice şi a exacerbărilor acestora (16).
Compoziţia microbiomului pulmonar şi
intestinal la vârstă mică poate avea rol esenţial în dezvoltarea ulterioară a
astmului bronşic. Stimularea bacteriană precoce determină reducerea
susceptibilităţii la astm prin creşterea toleranţei imune la bacterii, toleranţă
care persistă toată viaţa. În contrast cu această situaţie, perturbările
microbiomului determinate de infecţii recurente sau de administrarea excesivă
de antibiotice cresc semnificativ riscul pentru apariţia astmului bronşic.
Analiza genomică a microbiomului poate reprezenta un potenţial excepţional
pentru definirea relaţiilor acestuia cu fenotipul clinic şi evoluţia astmului
bronşic. În bolile obstructive pulmonare, posibilitatea de a manipula şi de a
modula speciile bacteriene din microbiom s-ar putea dovedi o sursă terapeutică
pentru viitor.
Dacă exacerbările astmului bronşic sunt
corelate, în toate studiile clinice, cu infecţii virale, bacteriene sau mixte,
se poate susţine că acest lucru este guvernat de calitatea şi funcţionalitatea
protectoare a microbiotei pulmonare, cheia echilibrului de siguranţă pentru
controlul hiperresponsivităţii bronşice. Proteobacteriile şi speciile de Haemophilus sunt semnificativ mai frecvent
întâlnite la pacienţii cu BPOC şi astm bronşic comparativ cu cei sănătoşi,
sugerând astfel o anumită implicare în patogenie prin menţinerea inflamaţiei
cronice a căilor aeriene. În schimb, Bacteroidetes,
în special Prevotella spp., au fost
mai frecvent întâlnite la pacienţii sănătoşi decât la cei astmatici sau cu
BPOC, sugerând un rol protector al acestora. Din perspectivă pediatrică, acest
studiu demonstrează clar prevalenţa proteobacteriilor la copiii cu astm bronşic
comparativ cu copiii sănătoşi. Specii ale genului Bacteroidetes sunt prezente în special la pacienţii sănătoşi,
demonstrând astfel un rol protectiv al acestora. Copiii astmatici au prezentat
colonizare excesivă cu Haemophilus spp. şi Staphylococcus spp., susţinând
rolul acestor patogeni în menţinerea şi exacerbarea astmului bronşic la copil.
În concluzie, infecţiile bacteriene sunt
strâns legate de astmul bronşic, putând – prin exacerbări şi severitate – să
deterioreze evoluţia bolii, să mărească necesarul de medicaţii patogenice, să
întreţină comorbidităţile astmului bronşic.
Independent de alţi factori de intervenţie,
infecţiile bacteriene au relaţie cu remodelarea mucoasei bronşice şi fibroza
pulmonară. Antibioticoterapia trebuie administrată judicios în perioada
neonatală şi de sugar mic, existând dovezi ale relaţiei pe termen lung cu apariţia
astmului bronşic. Rolul macrolidelor trebuie reţinut în ideea acţiunii
antiinfecţioase, dar şi antiinflamatorii.
Microbiota pulmonară trebuie cunoscută şi
menţinută sub aspectul ei protector. Ideea recentă, de păstrare a celor doi
factori protectori la distanţă (microbiota intestinală, posibil de modulat
nutriţional, şi microbiota locală, pulmonară, factor local de protecţie,
posibil de modulat prin vaccinare) se adaugă la ideile actuale de administrare
judicioasă a antibioticelor şi poate, în viitor, popularea cu Prevotella spp.