Terapia genică actuală, deși complexă ca procedură și scumpă, constituie o promisiune viabilă pentru atenuarea până la dispariţie a simptomatologiei bolilor hematologice ereditare monogenice și pentru creșterea calităţii vieţii, odată cu înlăturarea necesităţii tratamentului substitutiv.
 Iniţiată în urmă cu 50 de ani, timp în care a trecut prin etape de entuziasm și dezamăgire, terapia genică cunoaște în ultima perioadă progrese nebănuite de iniţiatorii ei, devenind una dintre marile povești de succes ale secolului XXI. Peste 2.600 de trialuri clinice au vizat acest domeniu în 2018, investigând diverse afecţiuni ereditare sau dobândite, inclusiv hematologice.
Iniţiată în urmă cu 50 de ani, timp în care a trecut prin etape de entuziasm și dezamăgire, terapia genică cunoaște în ultima perioadă progrese nebănuite de iniţiatorii ei, devenind una dintre marile povești de succes ale secolului XXI. Peste 2.600 de trialuri clinice au vizat acest domeniu în 2018, investigând diverse afecţiuni ereditare sau dobândite, inclusiv hematologice.
Editarea genică (sau genomică) constă în intervenţii asupra genomului prin care se realizează adăugiri, îndepărtări, înlocuiri sau modificări de substrat genetic în anumite poziţii ale genomului. Terapia genică presupune introducerea de material genetic în celulele somatice (transducţie) pentru a trata sau a preveni o boală.
Scopul său este de a asigura expresia durabilă a genei introduse în organismul pacientului (denumită „transgenă”) la un nivel suficient pentru ameliorarea sau eliminarea simptomatologiei bolii, dar cu evenimente adverse minime.
În bolile hematologice genetice, transducţia se realizează cu ajutorul unor „cărăuși”, denumiţi vectori, care constau din virusuri nepatogene incapabile de replicare, dar care pătrund în celulele organismului uman transportând gena atașată, integrându-se sau nu în genom. Vectorii cei mai folosiţi în prezent sunt:
- un parvovirus de dimensiuni mici asociat adenovirusului, obţinut prin recombinare (abreviat „rAAV”), cu tropism pentru hepatocite; aici, ansamblul vector-genă se distribuie sub formă de epizom, transducţia având astfel loc in vivo;
- un lentivirus, respectiv un retrovirus (deci capabil să se integreze în genomul celulei-gazdă), prelucrat prin inginerie genetică; ansamblul vector-genă este integrat in vitro în genomul celulelor stem hematopoietice recoltate de la pacient, după care celulele stem transduse sunt introduse înapoi în sângele acestuia, transducţia având astfel loc ex vivo.
Procedura este complexă și implică colectarea celulelor stem de la pacientul-donator prin leucafereză, cultivarea lor in vitro, transducţia cu ajutorul vectorului lentiviral, reintroducerea celulelor transduse în sângele pacientului după o mielocondiţionare.
Hemofilia ca boală ereditară monogenică indusă de mutaţii în genele care codifică factorul de coagulare VIII (hemofilia A) și IX (Hemofilia B) a fost unul dintre primii candidaţi ai terapiei genice (pentru mai multe informaţii despre hemofilie a se vedea și Viaţa Medicală numerele 16, 17, 18 și 19 din 2018.).
În urma solicitărilor repetate pe care comunităţile de pacienţi și medici le-au făcut de-a lungul anilor, mai multe companii din SUA,
precum și o companie din Olanda s-au lansat într-o adevărată cursă pentru obţinerea de preparate care să ofere o alternativă la terapiile existente pentru hemofilie.
Ele se află în stadii avansate privind aprobarea pentru lansarea pe piaţa farmaceutică a unor produse obţinute prin editare genică in vivo, destinate a fi aplicate în hemofilia A sau B.
Este vorba de valoctocogene roxaparvovec (Valrox), SB-525 și SPK-8011 (pentru hemofilia A), Fidanacogene elaparvovec și AMT 061 (pentru hemofilia B), toate având metodologia de producere bazată pe vectorul rAAV. S-a constatat că acestea induc, în urma unei singure administrări intravenoase, niveluri sangvine de factor de coagulare convenabile și relativ stabile pentru o perioadă de cel puţin zece ani.
Ca urmare, pacienţii constată absenţa sângerărilor și a necesităţii tratamentului substitutiv, respectiv a injecţiilor repetate, trăiesc o senzaţie de eliberare și înregistrează o creștere a activităţii, viaţa lor nu mai este dictată de hemofilie, ei nu mai trebuie să se supună „disciplinei brutale a profilaxiei” și nici să-și amintească faptul că sunt „diferiţi” de alţii.
Totuși, nu se poate vorbi de „vindecare” în sensul strict al cuvântului, deoarece prin terapia genică în hemofilie nu este îndepărtată anomalia moleculară cauzală, care poate fi transmisă, odată cu riscul de a prezenta simptomele bolii, la descendenţi.
De asemenea, durata beneficiului obţinut nu este încă pe deplin stabilită, aceasta putând fi variabilă de la un individ la altul, iar efectele unor readministrări repetate nu au fost încă analizate.
De menţionat că, având în vedere costul său ridicat, terapia genică se adresează doar pacienţilor cu hemofilie afectaţi de forme severe și medio-severe de boală.

Limitele tratamentului constau în efectele adverse: citoliza hepatică moderată (nivel crescut al transaminazelor), amendată de regulă prin corticoterapie, și apariţia anticorpilor neutralizanţi anti-proteine din capsida virusului-vector, care pot avea ca efect reducerea nivelului de factor.
De altfel, preexistenţa anticorpilor anti-vector la pacientul cu hemofilie contraindică iniţierea acestui tratament. Pe de altă parte, tratamentul nu este aplicabil, încă, la pacienţii pediatrici, în cazul cărora există și alte provocări, legate de procesul de creștere.
Costul tratamentului cu valoctocogene roxaparvovec (Valrox) este estimat că va fi între 2 și 3 milioane de dolari, el devenind cel mai scump tratament din lume.
Deși pare exorbitant, acest preţ a fost considerat acceptabil de asiguratorii americani, avându-se în vedere că un cost direct al tratamentului în hemofilie, efectuat conform standardelor actuale, se ridică în medie la peste 140.000 USD/an (circa 25 de milioane pe parcursul vieţii unui pacient) și la mai mult de 1 milion USD/an pentru cei 30% dintre pacienţii cu hemofilie care dezvoltă anticorpi anti-factor.
Aceste cifre îl situează drept cel mai scump tratament pentru o singură afecţiune din sistemul de asigurări (Medicare) din SUA (de aproximativ nouă ori mai mare faţă de media asiguraţilor). La aceste sume se adaugă costurile indirecte, prin scăderea capacităţii de muncă și a productivităţii, absenteism, invalidităţi și tratamente adjuvante, precum și afectarea calităţii vieţii.
Terapia genică în hemofilie trebuie privită cu un entuziasm moderat, ea fiind considerată în prezent o terapie experimentală (accesibilă numai în trialuri clinice) și fiind grevată de mai multe necunoscute, ce urmează a fi elucidate în perioada de urmărire, post-punere pe piaţă („postmarket surveillance”).
Hemoglobinopatiile beta (β), reprezentate de β-talasemie și siclemie, sunt printre cele mai răspândite boli ereditare monogenice din lume. Pentru ambele, singura opţiune curativă este alotransplantul de celule stem hematopoietice (CSH), grevat însă de riscuri vitale și complicaţii invalidante și rezervat în genere copiilor sub vârsta de 15 ani.
Compania BluebirdBio din SUA a realizat primul și, până în prezent, singurul produs farmaceutic obţinut prin terapie genică și aprobat pentru utilizare ce determină reducerea necesarului de transfuzii sau independenţa de acestea pentru perioade lungi de timp la pacienţii cu β-talasemie.
Sub denumirea de Zynteglo, acesta a fost aprobat condiţionat de EMA (Agenţia Europeană a Medicamentului) în iunie 2019, pentru pacienţii sub 12 ani cu β-talasemie dependentă de transfuzii (TDT), respectiv formele majoră și intermediară, care nu au genotipul β0/β0 și nu au un donator compatibil de celule stem hematopoietice.
Zynteglo are statut de medicament „orfan” (destinat afecţiunilor rare și severe) și a beneficiat de aprobare accelerată, dar condiţionată
(de monitorizare „adiţională”, cu raportări anuale). A fost luat în considerare faptul că se adresează unei boli care necesită cu celeritate un tratament adecvat, necesitate care depășește riscul lipsei unor date mai cuprinzătoare în raport cu cele cerute în mod normal.
Produsul constă într-o populaţie de CSH CD34+ autologe îmbogăţită (cel puţin 12 x 106 celule CD34+/kg corp), care conţine celule transduse ex vivo, prin intermediul vectorului lentiviral recombinant „LentiGlobine BB305”, cu gena globinei modificată prin inginerie genetică. Această genă este denumită βA-T87Q și este aptă să codifice un lanţ β funcţional.
Populaţia de CSH transduse este reinfuzată în sângele pacientului (în doză de minimum 5x106 celule/kg corp) după un tratament de condiţionare mieloablativ realizat cu un singur agent (Busulfan).
Această condiţionare este necesară pentru a facilita grefarea celulelor stem transduse, care rămân capabile de multiplicare o perioadă lungă de timp, transgena fiind transmisă la celulele progenitoare, asigurându-se astfel persistenţa ei în organismul pacientului (Fig. 1).
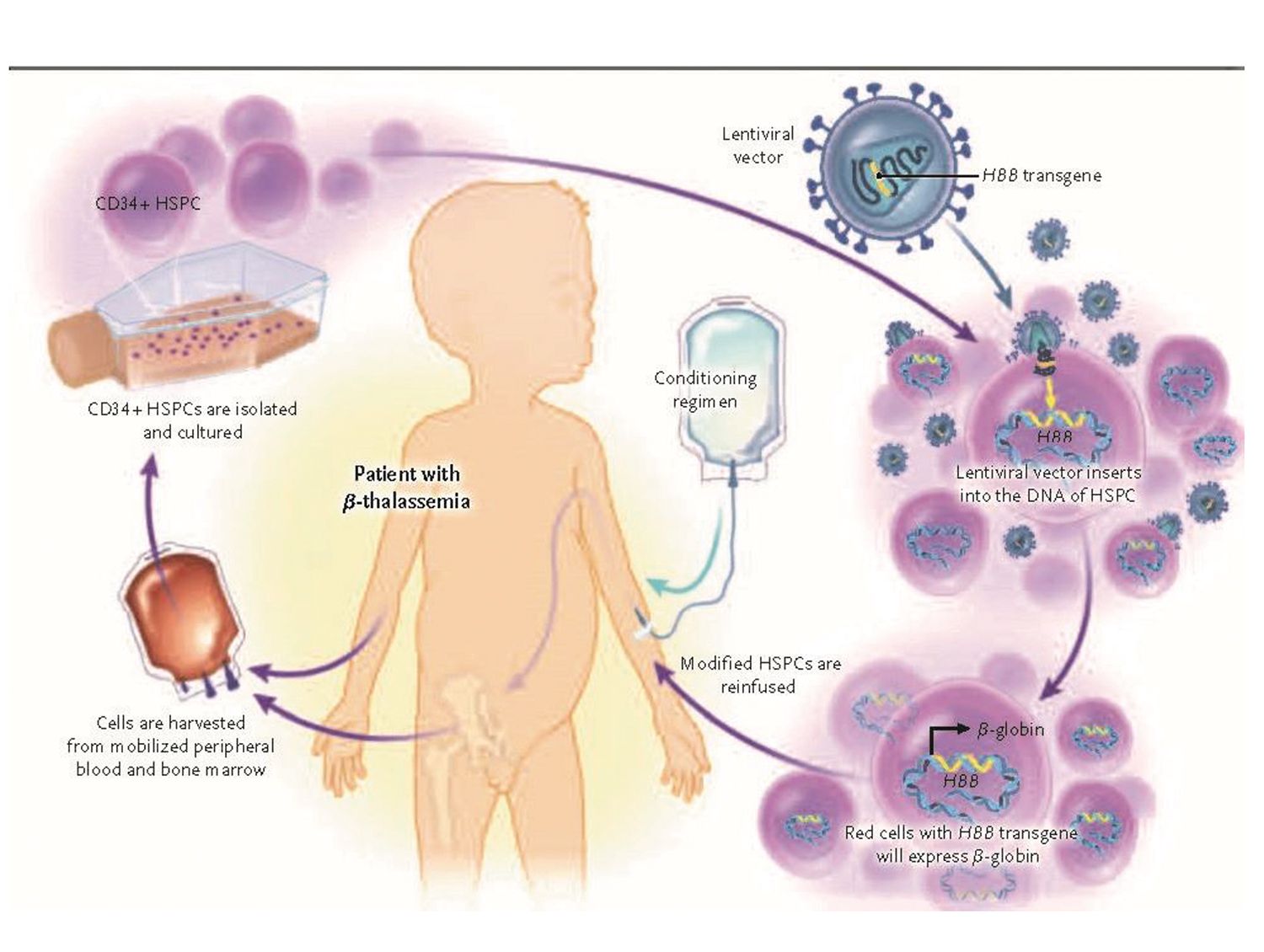
Acest tratament necesită condiţii de spitalizare și îngrijire asemănătoare cu cele ale pacientului supus unui transplant de măduvă osoasă. Pacienţii înregistrează o reducere treptată a necesarului de transfuzii, până la eliminarea acestora. Nivelurile de hemoglobină ajung la cel puţin 9 g/dl și rămân stabile timp de minimum trei ani.
Rezultatele sunt însă inferioare la cei cu genotipul β0/β0, adică la cei la care nu există deloc producţie de lanţuri globinice. Markerii de hemoliză și hematopoieză extramedulară se normalizează.
Nu s-au constatat efecte adverse legate de vector și nici elemente de mutageneză inserţională, dar pacienţii s-au confruntat cu efectele adverse uzuale, controlabile, ale tratamentului citostatic de condiţionare. Costul produsului este de 1,6 EUR, la care se adaugă, desigur, cheltuielile
legate de administrare.
Primul caz cu siclemie tratat cu succes prin terapie genică a fost relatat în 2017. S-a folosit aceeași metodologie ex vivo cu cea aplicată la cazurile de talasemie, utilizându-se produsul furnizat de BluebirdBio.
Pacientul, în vârstă de 13 ani, care anterior procedurii prezenta crize de siclizare frecvente, neameliorate de tratamentele existente, nu a mai prezentat evenimente caracteristice bolii pentru cel puţin 15 luni (perioada de urmărire până în prezent).
De asemenea, a înregistrat o ameliorare importantă a tuturor indicatorilor biologici specifici siclemiei, care au devenit comparabili cu cei ai martorilor heterozigoţi asimptomatici. Nu s-au constatat efecte adverse legate de celulele stem transduse.
Deși foarte încurajator, rezultatul obţinut trebuie tratat cu precauţie, fiind necesar un număr mai mare de cazuri (există trialuri în curs) și o urmărire mai îndelungată.
În concluzie, terapia genică actuală, deși complexă ca procedură și scumpă, constituie o promisiune viabilă pentru atenuarea până la dispariţie a simptomatologiei bolilor hematologice ereditare monogenice și pentru creșterea calităţii vieţii, odată cu înlăturarea necesităţii tratamentului substitutiv.
În afara produselor recent aprobate prezentate, numeroase alte preparate promiţătoare, obţinute prin metodologii variate, mai mult sau mai puţin sofisticate, se află în diverse faze experimentale, vizând și alte hemopatii genetice și anunţând o adevărată revoluţie terapeutică în domeniu.
Bibliografie
1. Boulad F. et al. Gene Therapy and Genome Editing. Hematol Oncol Clin N Am 2017, https://doi.org/10.1016/j.hoc.2017.11.007
2. High K. A., Roncarolo M. G. Gene Therapy. N Engl J Med 2019;381:455-64.
3. Pasi K. J. et al. Multiyear Follow-up of AAV5-hFVIII-SQ Gene Therapy for Hemophilia A. N Engl J Med 2020;382:29-40.
4. Machin N. et al. Gene therapy în hemophilia A: a cost-effectiveness analysis. Blood Adv. 2019, 2(14):1792
5. Thompson A.A. et al. Gene Therapy în Patients with Transfusion-Dependent β-Thalassemia. N Engl J Med 2018;378:1479-93
6. Harrison Ch. First gene therapy for β-thalassemia approved. Nature Biotechnology 2019,37:1099
7. Ribeil J.-A. et al. Gene Therapy în a Patient with Sickle Cell Disease. N Engl J Med 2017;376:848
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe