
Aplicarea haplo-TCSGH-PTCy ușurează accesul pacienţilor la un donator, respectiv la un tratament eficient.
Câteva aspecte practice (1) legate de aplicarea haplo-TCSH-PTCy merită a fi menţionate:
1) Ca urmare a multitudinii de studii care arată similitudinea dintre rezultatele obţinute cu TCSH HLA-compatibil înrudit/neînrudit și cu haplo-TCSH, există numeroase centre de transplant care nu recomandă începerea căutării unui donator compatibil decât la cazurile la care există contraindicaţii pentru haplo-TCSH sau la care nu poate fi identificat în familie un donator apt fizic sau psihologic de a dona celule stem hematopoietice.
2) Deși unele studii au arătat că regimul de condiţionare mieloablativ și cel cu toxicitate redusă nu se asociază cu diferenţe notabile privind mortalitatea legată de procedură, rata și durata remisiunilor, supravieţuirea totală, frecvenţa recăderilor, este indicat ca la pacienţii tineri și cu status bun de performanţă să fie preferată condiţionarea mieloablativă, iar la cei între 55 și 70 de ani – condiţionarea de intensitate redusă.
3) Sursa grefei pentru haplo-TCSH-PTCy poate fi atât medulară, cât și periferică, și deși există unele argumente în favoarea fiecăreia, măduva osoasă fiind recunoscută, de exemplu, pentru un risc mai redus al bolii grefă-contra-gazdă (BGcG) (2), celulele stem hematopoietice periferice constituie sursa de celule preferată pentru transplantare.
4) În cazul unui al doilea TCSH, este indicată utilizarea unui alt donator cu un haplotip diferit de cel anterior.
5) Regimurile de condiţionare mieloablative sunt preferabile în cazul pacienţilor cu vârsta <55 de ani și cu diagnosticul de leucemie acută mieloblastică (LAM), de leucemie acută limfoblastică (LAL) sau de sindrom mielodisplazic (SMD) (3).
6) Datele existente recomandă ca atunci când există mai mulţi donatori potenţiali să fie preferat cel cu vârsta mai mică (≤35 ani) și să fie evitaţi pe cât posibil părinţii, care induc un risc mai mare de BGcG și de transfer de hematopoieză clonală. Pot fi utilizate, in extremis, și rudele de gradul 2-3, precum nepoţii/strănepoţii, nepoţii de frate/soră, verii, cu menţiunea că la primitorii <40 de ani vârsta donatorului nu are importanţă. De asemenea, sexul donatorului trebuie avut în vedere în unele cazuri, precum situaţia donator feminin și primitor masculin (îndeosebi mamă-fiu), care se asociază cu o rată mai mare a BGcG și supravieţuire mai redusă, deși ponderea acestui criteriu este mai mică decât în cazul TCSH HLA-identic (1,4,5). Preferinţele în selecţia donatorului înrudit ar fi în următoarea ordine: fiul sau fiica, fratele mai tânăr, sora mai mare, tatăl, mama, o rudă de gradul al doilea (4).
7) Testarea prezenţei anticorpilor anti-HLA la potenţialii donatori este obligatorie. Prezenţa în sângele primitorului a anticorpilor specifici anti-antigene HLA ale donatorului, creditaţi cu o prevalenţă de 10-21% (situaţie mai frecventă la multipare), și îndeosebi un titru ridicat al acestora, constituie un puternic factor prohibitiv pentru haplo-TCSH și un element important în selecţia donatorului. El poate fi depășit în cazul în care diversele tehnici de desensibilizare existente dau rezultate;
8) Statusul serologic anti-virus citomegalic (VCM) primitor/donator trebuie avut în vedere, fiind preferată situaţia de similitudine serologică, îndeosebi dacă primitorul este VCM-negativ.
Intervalul de timp până la donarea efectivă este în medie de 2-4 săptămâni, faţă de~4 luni în cazul TCSH-compatibil neînrudit. Rata de grefare este considerată excelentă, fiind de 90-100% în ziua +30 (6-8). Proporţia cazurilor în care a apărut insuficienţă primară a grefei a fost de doar 4% (4).
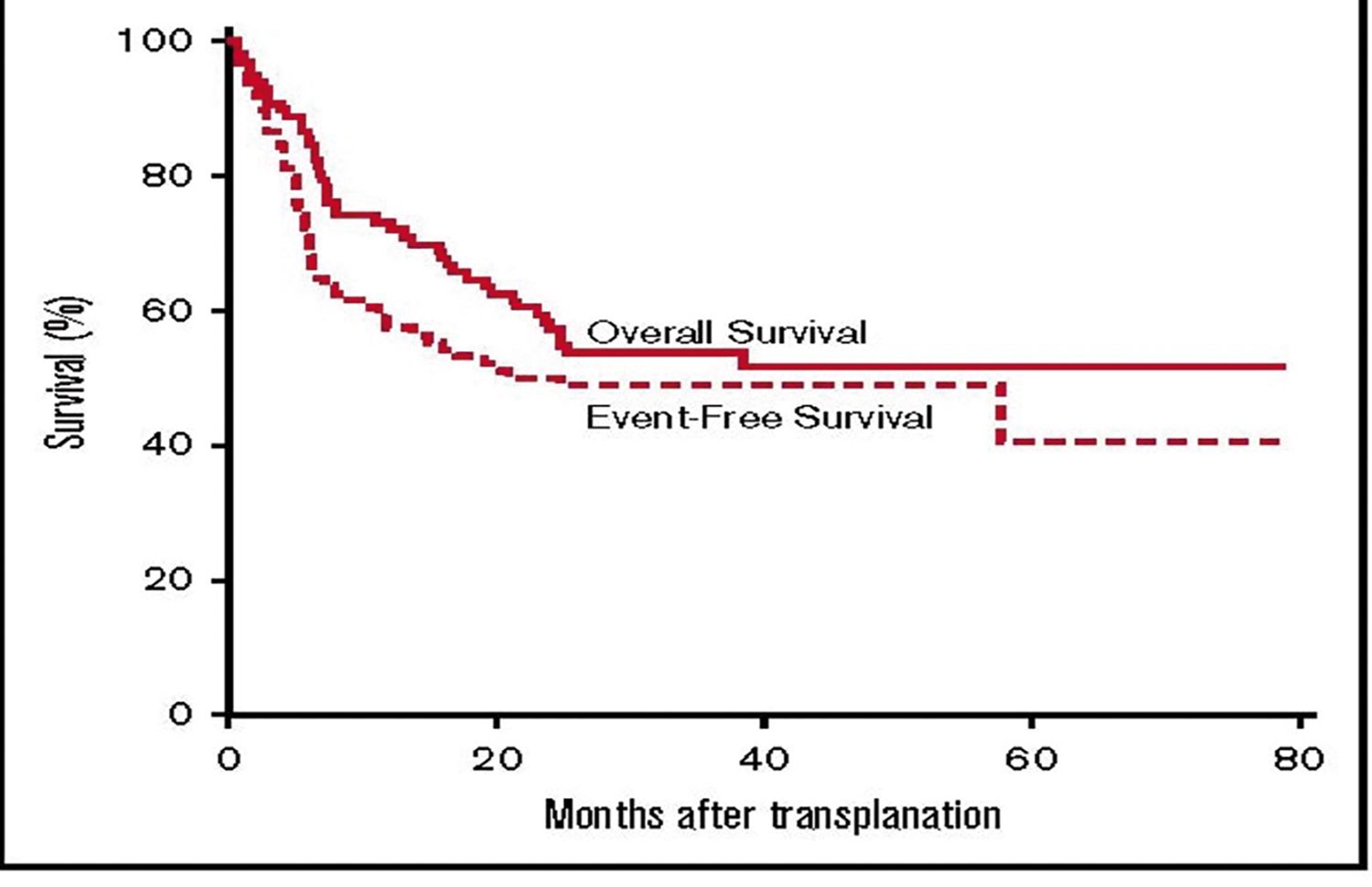
Supravieţuirea totală la 1 an a fost de 73%, la 3 ani de 54%; rata remisiunilor la 1 an a fost de 54%, iar la 3 ani de 49%, mai redusă la pacienţii >55 ani (18) (Fig. 1).
Fig. 1. Supravieţuirea totală și în remisie posthaploTCSH-PTCy. Reprodus după Symons H.J., 2020 (19)
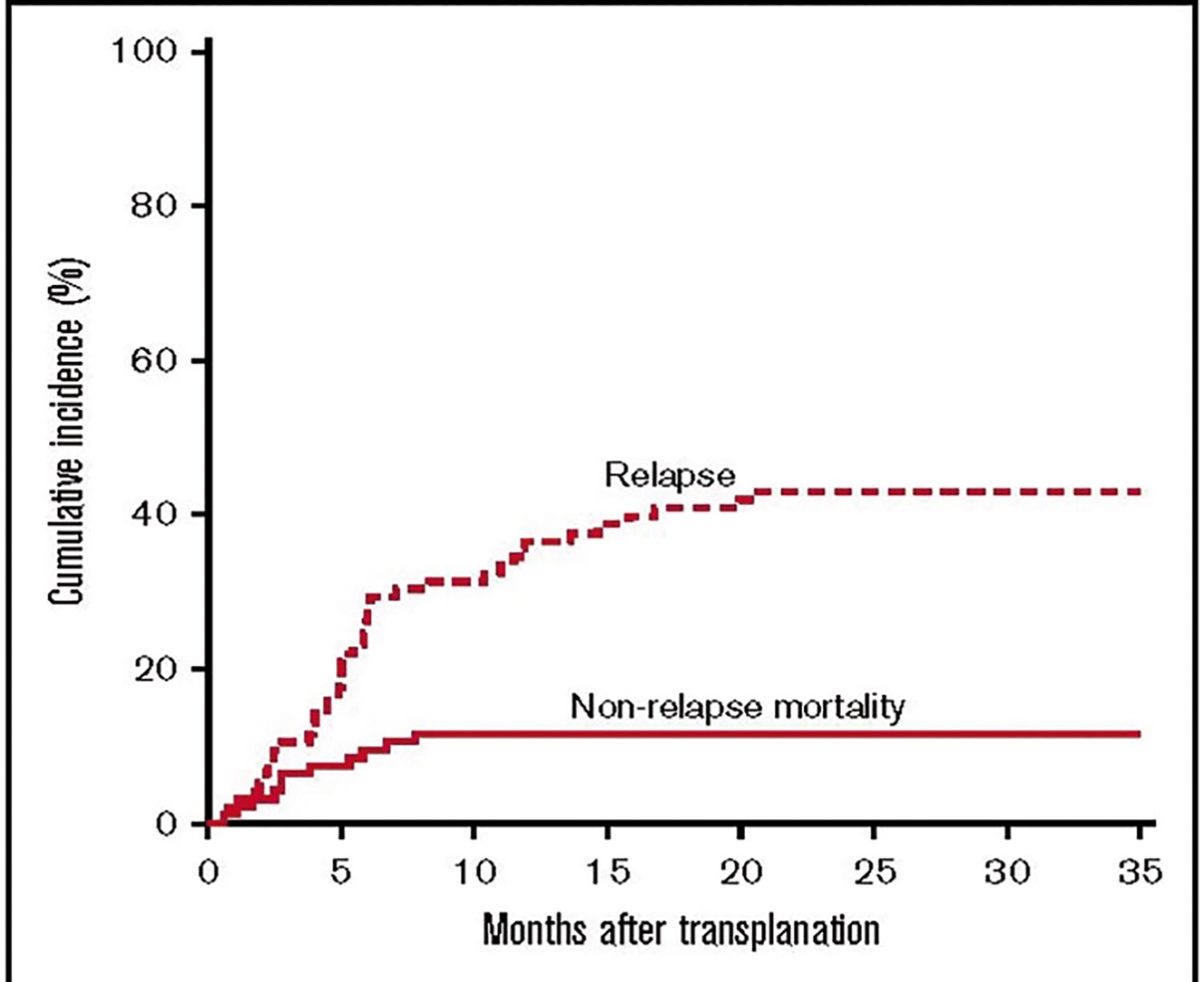
Proporţia recăderilor la pacienţii cu leucemii acute și limfoame a fost de 35% la 1 an și de 43% la 3 ani, mortalitatea determinată de recădere fiind principala cauză de deces la pacienţii care au primit haplo-TCSH-PTCy (Fig. 2) (9).
Fig. 2. Incidenţa cumulată a mortalităţii posthaploTCSH-PTCy. Reprodus după Symons H.J. et al, 2020 (19)
Mortalitatea nelegată de recădere (MNR) a fost de 6% la 100 de zile și de 11% la 1 an (19% la cei cu vârsta ≥55 ani) (8,9), iar mortalitatea prin infecţii – de 9-12%, aceasta fiind principala cauză a MNR (3).
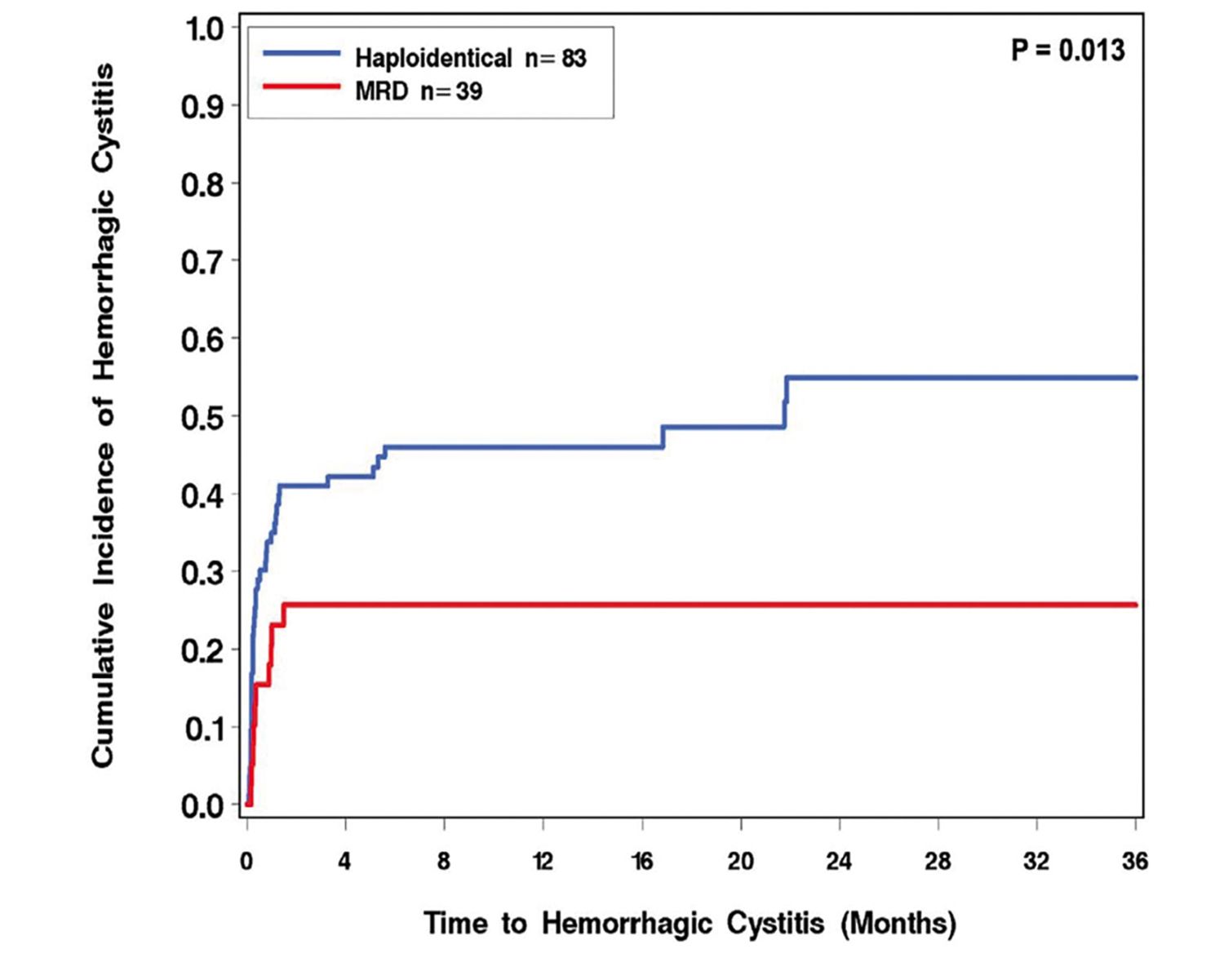
Specifice haplo-TCSH sunt incidenţa mare a reactivării infecţiei cu virusul citomegalic (VCM) și incidenţa crescută a cistitei hemoragice (Fig. 3), caracteristică fiind frecvenţa de două ori mai mare a asocierii cu poliomavirusul BK și cu o gravitate crescută faţă de alte proceduri de transplant (10).
Fig. 3. Incidenţa cumulată a cistitei hemoragice în haplo-TCSH-PTCy vs. TCSHidentic familial (n=122). MRD = „matched related donor” (donator identic înrudit). Reprodus după Copelan O.R. et al, 2019 (21)
Incidenţa cumulată a complicaţiei BGcG acută gradul II-IV la 100 de zile a fost de 4-11%, iar a BGcG cronică la 12 luni cu forme moderate/severe – de 6%, semnificativ mai redusă decât în cazul TCSH HLA-compatibil cu donator înrudit/neînrudit. Incidenţa cumulată a BGcG acută și cronică nu a fost influenţată de gradul de nepotrivire a antigenelor HLA (3/6 sau 4-5/6) (6,8,11).
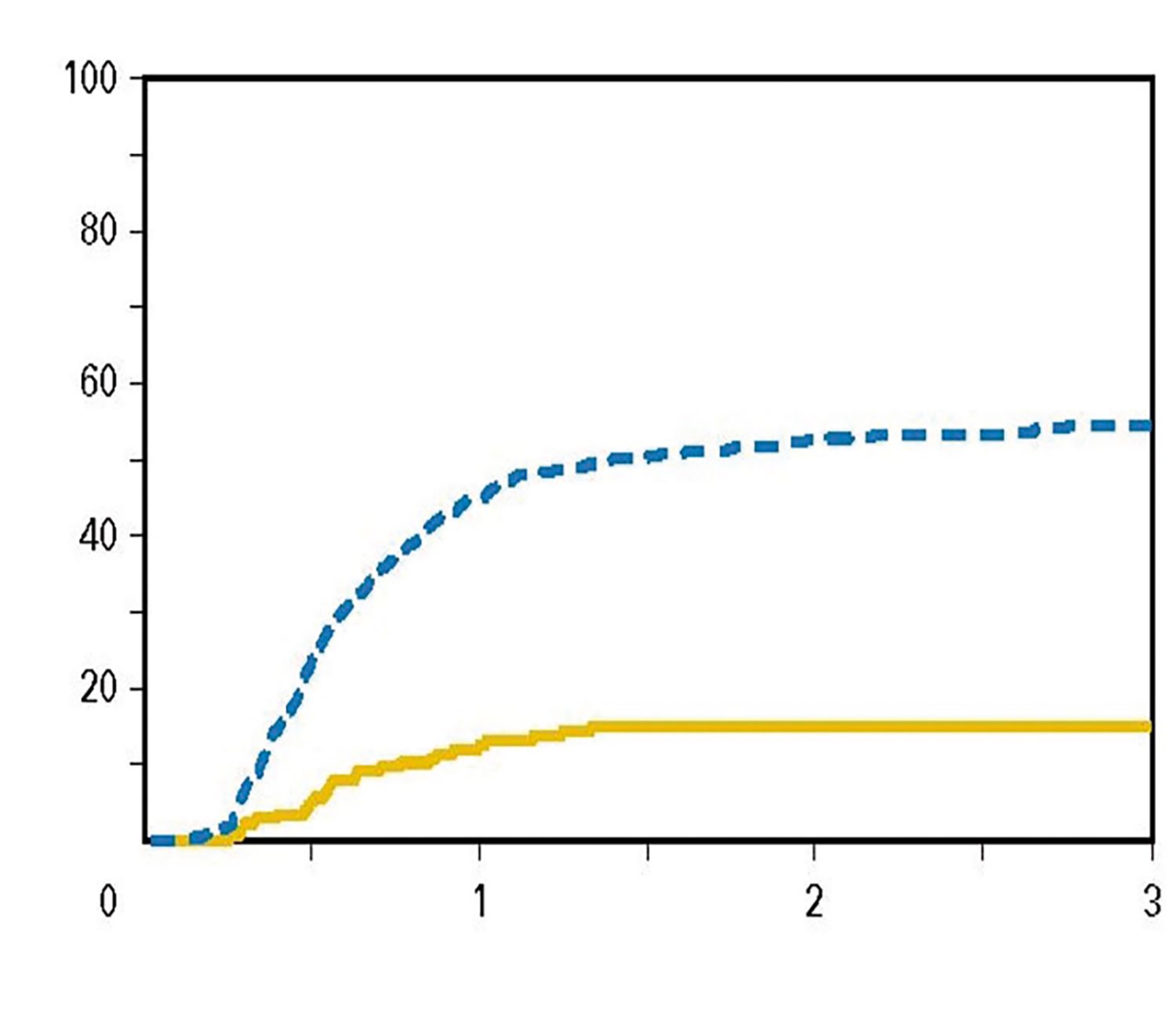
Incidenţa semnificativ mai redusă a BGcG, îndeosebi cronică, este o caracteristică a haplo-TCSH-PTCy, demonstrată de majoritatea studiilor efectuate până în prezent (8), ilustrată și în Fig. 4.
Fig. 4. Incidenţa cumulată a BGcG cronică la primitorii de TCSH haploidentic și HLA-identic familial cu limfom nonHodgkin. Reprodus după Ghosh N. et al, 2016 (31)
Incidenţa cumulată a recăderilor la 1 an a fost de 35%, iar la 3 ani – de 43%, rata ridicată asociindu-se cu vârsta >55 ani și cu nivelul bolii minime reziduale (3).
Haplo-PTCy s-a dovedit o bună alternativă și pentru pacienţii pediatrici (copii și adolescenţi), atât cu leucemie acută (LA), cât și cu anemie aplastică refractară, care nu au frate/soră compatibil (3,7).
Incidenţa recăderilor, mortalitatea legată de transplant, rata remisiunilor și a supravieţuirilor la doi ani au fost semnificativ mai bune decât în cazul TCSH cu celule stem provenite din cordonul ombilical (4). În absenţa unui donator identic înrudit, aceste date recomandă haplo-TCSH drept o procedură preferabilă celei cu donator HLA-compatibil neînrudit (1,17). De menţionat că la Universitatea Johns Hopkins, haplo-TCSH-PTCy a devenit procedura standard pentru toate transplanturile medulare alogene (11).
Haplo-TCSH-PTCy a fost aplicat cu succes în diverse hemopatii non-maligne și maligne, ca de exemplu în aplazia medulară forma severă refractară la copii și adulţi (7,12), în LAM și LAL (13-15), în limfomul nonHodgkin (LNH) (16,17) și, îndeosebi, în limfomul Hodgkin (LH)(18-20).
Deși LH clasic este considerat o boală vindecabilă, 15-20% dintre pacienţi se dovedesc a fi rezistenţi la chimio-radioterapie sau recad după aceasta, având o supravieţuire la 5 ani de doar~30%. Pentru cei ce recad după transplantul medular autolog, transplantul medular alogen, îndeosebi cel haplo-TCSH-PTCy, s-a dovedit a fi o modalitate terapeutică eficace, deși capacitatea sa curativă este limitată de numărul încă mare de recăderi (18,21).
Într-o serie de studii (27-29), un bun control al bolii a fost înregistrat la 87% dintre cazuri, iar procentul supravieţuitorilor și al celor în remisiune la 3 ani a fost de 53-63% și, respectiv, de 44-59%. În ansamblu, proporţia pacienţilor la care s-a înregistrat o remisiune de LH cu absenţa BGcG post-haplo-TCSH-PTCy a fost de 47%, faţă de numai 17% la cei care au primit TCSH -HLA-identic (20). De menţionat că regimul de condiţionare a fost predominant non-mieloablativ. Rezultatele au fost considerate neașteptat de bune și au fost puse pe seama reducerii procentului recăderilor, datorat efectului de grefă-contra-micromediu, cu apoptoza celulelor Reed-Sternberg, efect amplificat de nepotrivirea dintre antigenele HLA donator/primitor (22). Ele explică în bună parte creșterea numărului de alo-TCSH în LH constatată în ultimii ani, cu toate progresele datorate imunoterapiei (21).
De menţionat că rezultatele bune s-au obţinut la pacienţii cu LH la care a existat un bun control al bolii în momentul transplantului (25-27), deși există raportări recente ale unor reușite ale aplicării haplo-TCSH-PTCy la pacienţi cu boala stabilă sau progresivă după chimioterapia de salvare (Ciurea, 2020).
În concluzie, haplo-TCSH-PTCy a devenit deja procedura standard pentru pacienţii care nu au un donator înrudit HLA-identic sau unul înrudit dar compatibil pentru mai puţin de 8 antigene HLA, ca și pentru pacienţii cu LH, unde TCSH haploidentic a indus rezultate superioare transplantului de la donator compatibil. După ce va fi validat ca atare prin trialuri randomizate (în curs), metoda poate deveni și procedura standard pentru transplantul medular în ansamblu, înlocuind-o pe cea clasică, ce folosește un donator HLA compatibil 100%.
Bibliografie
1. Bashey A, Solomon SR. T-cell replete haploidentical donor transplantation using post-transplant CY: an emerging standard-of-care option for patients who lack an HLA-identical sibling donor. Bone Marrow Transplantation (2014) 49, 999
2. Luznik L. et al. HLA-Haploidentical bone marrow transplantation for hematologic malignancies using nonmyeloablative conditioning and high-dose, posttransplantation cyclophosphamide. Biol Blood Marrow Transplant. 2008;14(6):641, doi:10.1016/j.bbmt.2008.03.005.
3. Bayraktar U.D., Champlin R.E., Ciurea S.O. Progress in haploidentical stem cell transplantation. Biol Blood Marrow Transplant. 2012; 18(3): 372. doi:10.1016/j.bbmt.2011.08.001.
4. Ciurea S.O. et al. Improved early outcomes using a T cell replete graft compared with T cell depleted haploidentical hematopoietic stem cell transplantation. Biol Blood Marrow Transplant. 2012;18(12): 1835. doi:10.1016/j.bbmt.2012.07.003.
5. Elmariah H., Fuchs E.J. Post-transplantation cyclophosphamide to facilitate HLA-haploidentical hematopoietic cell transplantation: mechanisms and results. Seminars in Hematology 2018, doi.org/10.1053/j.seminhematol.2018.09.002
6. Tanase A. et al. Haploidentical donors: Can faster transplantation be life-saving for patients with advanced disease? Acta Haematol 2016;135:211
7. Tănase A. et al. First successful haploidentical stem cell transplantation in Romania. Rom. J. Intern. Med., 2016, DOI: 10.1515/rjim-2016-0021
8. Dubois V. et al. Greffe de cellules souches hématopoïétiques haplo-identiques avec cyclophosphamide en post-greffe : comment choisir le meilleur donneur en 2019 ? Recommandations de la Société francophone de greffe de moelle et de thérapie cellulaire (SFGM-TC). Bull Cancer 2020,107:S72–S84
9. Pitombeira de Lacerda M. et al. Human Leukocyte Antigen–haploidentical transplantation for relapsed/refractory Hodgkin lymphoma: A multicenter analysis. Biol Blood Marrow Transplant 2017,23:691
10. McCurdy S.R, Luznik L. Immune reconstitution after T-cell replete HLA-haploidentical transplantation. Seminars in Hematology 2019,56:221
11. Kongtim P., Ciurea S.O. Who is the best donor for haploidentical stem cell transplantation? Seminars in Hematology 2019,56(3):194, doi.org/10.1053/j.seminhematol.2018.08.003
12. Shabbir-Moosajee M. et al. An overview of conditioning regimens for haploidentical stem cell transplantation with post-transplantation cyclophosphamide. American Journal of Hematology 2015,90( 6):541. doi:10.1002/ajh.23995.
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe