Majoritatea pacienţilor cu cancer pulmonar sunt diagnosticaţi în stadiu avansat, din cauza faptului că semnele și simptomele iniţiale sunt nespecifice și adesea neglijate.
Acest lucru duce la o rată mică de supravieţuire, de aproximativ 17%, rată care crește în cazul pacienţilor depistaţi în faze incipiente ale bolii, sugerând necesitatea diagnosticului precoce și a implementării mijloacelor de screening pentru populaţia care prezintă factori de risc.
Cancerul pulmonar este principala cauză de deces prin cancer, în anul 2020 înregistrându-se aproximativ 1,8 milioane de decese la nivel mondial. Este cel mai frecvent tip de cancer la bărbaţi și al doilea la femei, după cancerul de sân.

Majoritatea cazurilor de cancer pulmonar sunt reprezentate de carcinomul fără celule mici (NSCLC), întâlnit în aproximativ 80-90% din totalul cazurilor, restul fiind reprezentate de carcinomul cu celule mici (SCLC). În cele ce urmează vom face referire la NSCLC.
- fumatul de tutun;
- expunerea profesională – azbest, siliciu, radon, metale grele și hidrocarburi policiclice aromatice;
- poluarea atmosferică, inclusiv a aerului de interior – arderea cărbunelui în case slab ventilate, a lemnului și a altor combustibili solizi, fumul de la gătirea la temperaturi ridicate folosind uleiuri vegetale nerafinate, cum ar fi uleiul de rapiţă;
- factori genetici – responsabili de aproximativ 8% dintre cancerele pulmonare.
Deși manifestările cancerului bronhopulmonar sunt diverse,
niciun simptom nu este patognomonic:
manifestările cauzate de creșterea tumorală locală și diseminarea intratoracică: tuse, dispnee, durere toracică, hemoptizie, pneumonie, paralizie de corzi vocale, pleurezie, sindrom de venă cavă superioară, pericardită, sindrom Pancoast-Tobias;
manifestările cauzate de metastazele la distanţă: pot fi prezente ca un prim semn al bolii; majoritatea pacienţilor sunt depistaţi în faze tardive, aproximativ 70% dintre ei prezentând metastaze la examenul iniţial; acestea pot fi asimptomatice sau pot produce diverse tulburări, în funcţie de localizare și dimensiuni; organele cel mai frecvent afectate sunt: sistemul nervos central, ficatul, glandele suprarenale și sistemul osos;
simptomele generale nespecifice: astenie, anorexie, scădere ponderală, febră, anemie; apariţia manifestărilor generale nespecifice reprezintă un factor de prognostic nefavorabil;
sindroamele paraneoplazice: se întâlnesc în proporţie de 10-20%; apar ca o consecinţă a creșterii secreţiei de hormoni ectopici de către ţesutul tumoral; apar mai frecvent în carcinomul cu celule mici și sunt reprezentate de:
– sindroame endocrine (sindromul Bartter, hipercalcemia,
ginecomastia);
– sindroame neurologice (sindromul Eaton-Lambert, encefalopatia limbică, sindromul paraneoplazic vizual);
– sindroame cutanate sau musculoscheletale (osteoartropatia pulmonară hipertrofică, acanthosis nigricans, dermatomiozita);
– sindroame cardiovasculare și hematologice (tromboflebite migratorii, endocardita trombotică abacteriană);
– sindroame renale (glomerulonefrite, sindrom nefrotic).
Pentru diagnosticul și stadializarea cancerului pulmonar sunt necesare teste imagistice și analize tisulare/patologice care să precizeze atât tipul histopatologic, cât și prezenţa mutaţiilor genetice.
1. Radiografia pulmonară
Este prima investigaţie care poate sugera diagnosticul de cancer pulmonar în prezenţa unei opacităţi tumorale, atelectazie, consolidări, efuziuni pleurale sau lărgirea mediastinului. O metaanaliză publicată în 2019 sugerează că sensibilitatea radiografiei toracice pentru cancerul pulmonar simptomatic este de doar 77-80%, de aceea practicienii ar trebui să ia în considerare necesitatea unei investigaţii suplimentare la pacienţii cu risc crescut care au o radiografie toracică fără modificări.
2. Tomografia computerizată toracică (CT)
CT oferă informaţii suplimentare despre localizarea și extensia tumorii, prezenţa adenopatiilor sau a metastazelor. Cu toate acestea, criteriile CT pentru adenopatie se bazează numai pe dimensiune și nu reflectă întotdeauna cu exactitate prezenţa sau absenţa metastazelor tumorale. CT poate fi considerată o tehnică ce oferă un plan de acţiune pentru o etapă de confirmare ulterioară.
3. Tomografia cu emisie de pozitroni (PET-CT)
PET-CT este o tehnică clasică de imagistică pentru diagnosticul, stadializarea și re-stadializarea cancerului pulmonar, evaluarea efectului terapeutic și a prognosticului acestuia. În plus, valoarea maximă standardizată de absorbţie (SUV max) se corelează cu tipul patologic și gradul de diferenţiere al cancerului pulmonar și este un indicator al capacităţii proliferative a celulelor neoplazice
pulmonare.
4. Rezonanţa magnetică nucleară (RMN)
RMN este utilizată în diferenţierea tumorii de atelectazia de însoţire, în determinarea invaziei cardiace, mediastinale, parietale, ganglionare, având avantajul lipsei iradierii. Studiul „Streamline L” a arătat performanţe diagnostice echivalente între RMN „total” (al întregului corp) și PET-CT asociat cu RMN ţintit la nivelul organului cu suspiciune de metastază, privind dimensiunea tumorii, invazia și stadializarea metastatică, intervalul de timp scăzut pentru completarea stadializării și costurile de diagnostic, comparativ cu standardul de stadializare.
5. Bronhoscopia
Este examenul de elecţie pentru vizualizarea modificărilor endobronșice și pentru recoltarea de ţesut în vederea diagnosticului histopatologic de certitudine.
Bronhoscopia flexibilă este procedura recomandată pentru toţi pacienţii suspectaţi de cancer pulmonar, prezentând o sensibilitate de 88% pentru leziunile situate central, respectiv de 78% în diagnosticul bolii periferice (36-88%, conform metodei de biopsie folosită).
Modificările endobronșice pot fi semne directe ale procesului tumoral propriu-zis și/sau semne de însoţire ale bronhiilor și ţesutului pulmonar juxtatumoral.
Combinarea bronhoscopiei cun ultrasonografia endobronșică (EBUS) și/sau endoesofagiană (EUS) permite atât diagnosticul, cât și stadializarea cancerului pulmonar, prin evaluarea ganglionilor limfatici regionali, având o sensibilitate de 86% și o valoare predictivă negativă de 88%.
În plus, puncţia ganglionară transbronșică (TBNA) este mai puţin invazivă comparativ cu mediastinoscopia, iar specimenele citologice obţinute prin TBNA sunt potrivite pentru testarea moleculară pentru EGFR (gena receptorului factorului de creștere epidermală), KRAS (oncogena virală omoloagă a sarcomului Kirsten rat), ALK (limfom kinaza anaplastică) etc.
În cazul leziunilor periferice se indică puncţia aspirativă transtoracică percutană cu ac fin și/sau biopsie, sub ghidaj CT. Biopsia cu ac fin are o acurateţe de aproximativ 88%, o sensibilitate de 90% și o rată fals negativă de 22%.
Cel mai mare dezavantaj al procedurii este riscul de pneumotorax, de până la 50%. În afara tehnicii clasice de efectuare a bronhoscopiei, utilizând lumina albă, în ultimii ani au fost dezvoltate tehnici de examinare utilizând diverse lungimi de undă.
a. Bronhoscopia cu autofluorescenţă (AFB) oferă posibilitatea de a diferenţia ţesutul celular normal de ţesutul displazic și carcinomul in situ, datorită floroforilor endogeni, substanţe care absorb și emit fluorescenţa verde când sunt expuse la lumină violet sau albastră, fiind o tehnică cu posibilă utilitate în screeningul cancerului pulmonar.
Autofluorescenţa este indicată și pentru monitorizarea pacienţilor cu displazie sau carcinom in situ, permiţând stabilirea intervalului de rezecţie chirurgicală și determinând astfel reducerea ratei de recurenţă postoperatorie.
b. Narrow-band imaging (NBI) este o tehnică ce îmbunătăţește vizualizarea arhitecturii microvasculare endobronșice. S-a demonstrat faptul că NBI este mai bun decât AFB în detectarea leziunilor premaligne ale căilor respiratorii, prezentând o sensibilitate, specificitate și un raport de probabilitate de diagnostic de 80%, 84% și, respectiv, 31,49%.
NBI permite diferenţierea dintre carcinomul in situ, tumorile micro-invazive și invazive, putând orienta către diagnosticul de adenocarcinom sau tumoră scuamoasă.
c. Bronhovideoscopia cu magnificare înaltă (HMB) poate evidenţia sistemul vascular al mucoasei bronșice, având o putere de magnificare de 55 până la 110 ori, datorită combinaţiei dintre sistemul video pentru mărire a imaginii și sistemul de fibre optice pentru orientarea bronhoscopului. HMB ar putea detecta displazia mai precis decât bronhoscopia cu fluorescenţă, cu o sensibilitate și o specificitate de 71,4%, respectiv 90,9%.
d. Tomografia cu coerenţă optică (OCT) poate fi utilă în combinaţie cu bronhoscopia cu autofluorescenţă în diferenţierea cancerului invaziv de carcinomul in situ și a displaziei de metaplazie, hiperplazie și ţesut normal, prin măsurarea cantitativă a grosimii epiteliului și a modificărilor din structura acestuia.
e. Endomicroscopia laser confocală (CLE) reprezintă o nouă tehnologie optică ce permite vizualizarea neinvazivă, în timp real, a imaginilor histologice cu ajutorul unui laser cu lungime de undă de 488 nm direcţionat către spaţiile alveolare.
Sonda subţire semiflexibilă poate fi introdusă în căile respiratorii distale prin canalul de lucru al bronhoscopului și, datorită rezoluţiei laterale de 3 μm și adâncimii de focalizare de 50 μm, poate fi considerată o endomicroscopie tridimensională, obţinând informaţii privind diferenţele dintre diferitele subtipuri de cancer pulmonar în funcţie de componenta stromală și parenchimatoasă, permiţând identificarea carcinomului
pulmonar în probe ex-vivo.
f. Spectroscopia cu laser Raman (LRS) este o metodă experimentală ce poate oferi un diagnostic în timp real, pe baza analizei de benzi spectrale asemănătoare amprentelor din ţesuturi cu
diverse compoziţii moleculare.
Poate fi utilă în îmbunătăţirea specificităţii pentru detecţia precoce a leziunilor canceroase, în combinaţie cu fibrobronhoscopia în lumină albă sau cu autofluorescenţă, cu o sensibilitate de 96% și o specificitate de 91%.
6. Toracocenteza
În prezenţa unui revărsat pleural, toracocenteza reprezintă metoda utilizată atât în scop diagnostic, cât și în scop paliativ. Dacă examenul citologic este negativ, se recomandă biopsia pleurală ghidată imagistic sau toracoscopia chirurgicală.
7. Metode chirurgicale invazive
În cazul în care aceste tehnici nu oferă posibilitatea unui diagnostic precis, se poate recurge la metode chirurgicale invazive, precum mediastinoscopia, mediastinotomia, toracoscopia sau chirurgia toracoscopică (VATS).
Biopsia tisulară, standardul de aur
În prezent, biopsia de ţesut este standardul pentru diagnosticul molecular al cancerului, fiind indicat a se obţine utilizând tehnica cel mai puţin invazivă, din tumora primară sau din metastaze (cu excepţia metastazelor osoase).
Pe de altă parte, heterogenitatea tumorală și posibilitatea transformării tumorii prezintă provocări semnificative în managementul bolii. Efectuarea de biopsii repetate pe parcursul evoluţiei bolii neoplazice este adesea dificilă, riscantă, costisitoare și de multe ori imposibil de realizat.
Drept urmare, a apărut necesitatea unor noi metode, mai puţin invazive, care ar putea detecta în mod eficient schimbările la nivel molecular apărute pe parcursul tratamentului și ar identifica alte mecanisme de rezistenţă care pot necesita tratament alternativ (transformarea SCLC, amplificarea MET, modificări HER2 etc.).
În acest sens, biopsia lichidă presupune o simplă probă de sânge recoltată într-un kit special, care permite testarea pe o varietate de biomarkeri de cancer, cum ar fi ADN-ul tumorii circulante (ADNct), microARN și celulele tumorale circulante (CTC).
În același timp, testarea ADNct le poate aduce beneficii pacienţilor care nu sunt trataţi prin proceduri invazive sau atunci când nu există suficiente probe de ţesut și pentru testarea moleculară. Cu toate acestea, un rezultat negativ al biopsiei lichide nu exclude prezenţa unor modificări oncogene, iar testele bazate pe biopsia tisulară trebuie efectuate ori de câte ori este posibil.
Imunohistochimia a devenit atât o metodă-cheie în diagnosticul primar al cancerului, cât și un biomarker predictiv al evoluţiei bolii. În cazurile de NSCLC în care subtiparea specifică nu este posibilă doar prin intermediul examenului morfologic, testele imunohistochimice sunt recomandate.
Factorul de transcripţie tiroidian 1 (TTF1) și/sau Napsin A pozitive sunt asociate cu diagnosticul probabil de adenocarcinom, în timp ce p40, CK5/6 și TP63 (p63) pozitive sunt asociate cu
diagnosticul probabil de carcinom scuamos. Dacă ambele sunt
negative, diagnosticul este de NSCLC nespecificat (NOS).
Dintre cele trei subtipuri histologice principale ale NSCLC, adenocarcinomul pulmonar (ADK) este cel mai frecvent, urmat de carcinomul cu celule scuamoase pulmonare și carcinomul cu celule mari.
Pe lângă faptul că au aspecte histologice diferite, aceste subtipuri au și profiluri genetice unice. Mutaţiile genetice obligatorii de testat sunt EGFR, ALK, ROS1, BRAF, împreună cu nivelul de expresie al PD-L1 și, dacă este disponibil suficient ţesut, un al doilea grup de gene trebuie inclus în orice panou extins (MET, RET, ERBB2, KRAS). Imunohistochimia pentru PD-L1 este obligatorie pentru toţi pacienţii cu NSCLC avansat nou diagnosticat.
PUBLICITATE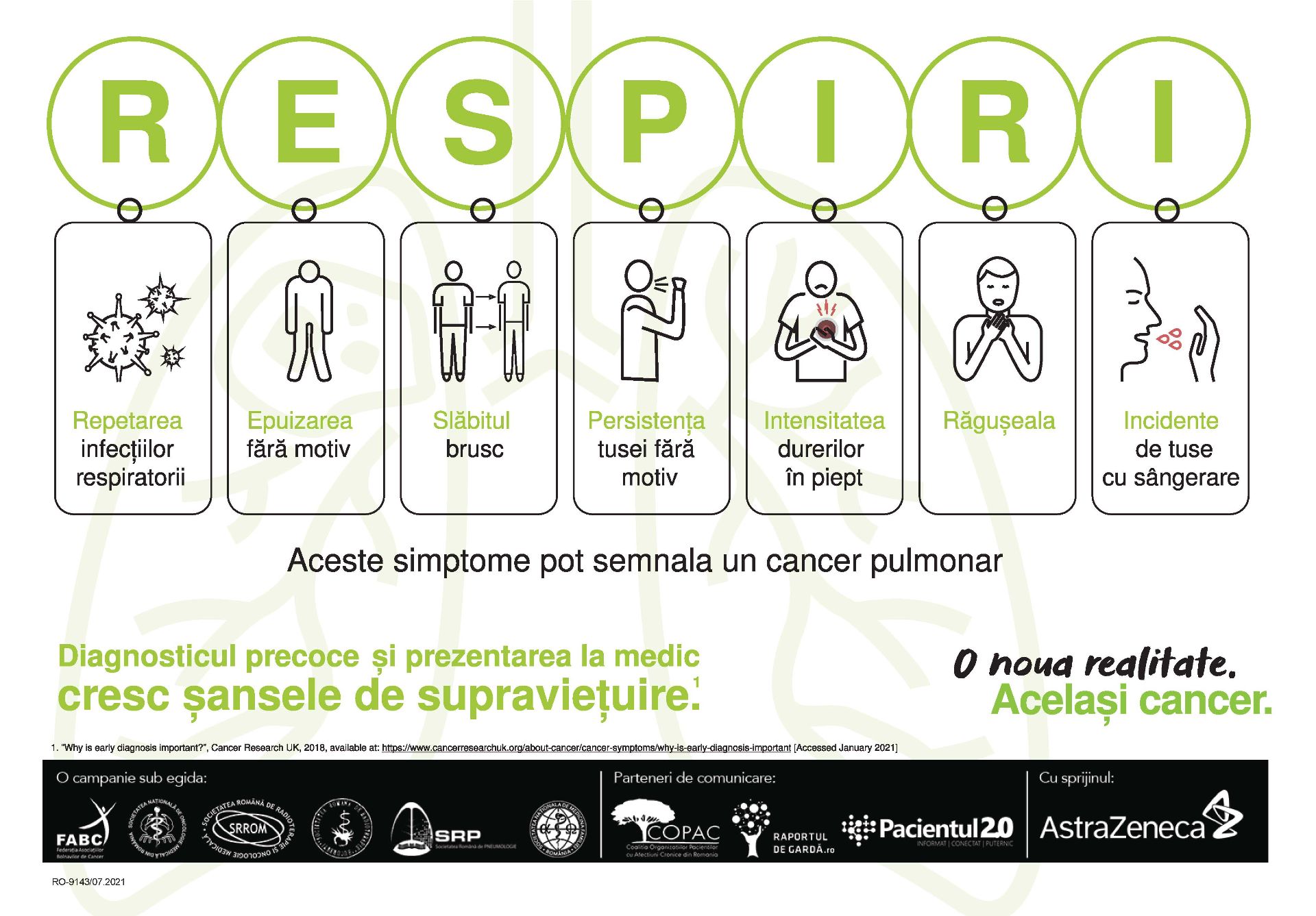
Bibliografie
1. Sung H, Ferlay J, Siegel R, Laversanne M, Soerjomataram I, Jemal Abray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries CA Cancer J Clin 2021;0:1–41
2. Barzi A and Pennell NA. Targeting angiogenesis in non-small cell lung cancer: agents in practice and clinical development. EJCMO 2010; 2(1):31-42
3. Alexander M, Kim SY, Cheng H. Update 2020: Management of Non Small Cell Lung Cancer. Lung (2020) 198:897–907
4. Malhotra J, Malvezzi M, Negri E, La Vecchia C, Boffetta P. Risk factors for lung cancer worldwide. European Respiratory Journal 2016; 48 (3): 889-902
5. Hech SS. Lung carcinogenesis by tobacco smoke. Int J Cancer.2012;131(12):2724-32
6. Taylor R, Najafi F, DobsonA.Meta. Analysis of studies of passive smoking and lung cancer: effects of study type and continent. Int J Epidemiol.2007;36(5):1048-59
7. Tang MS, Wu XR, Lee HW, Xia Y, Deng FM, Moreira AL, Chen LC, Huang WC, Lepor H. Electronic-cigarette smoke induces lung adenocarcinoma and bladder urothelial hyperplasia in mice. Proc Natl Acad Sci USA 2019; 116(43):21727–21731
8. Cogliano VJ, Baan R, Straif K, et al. Preventable exposures associated with human cancers. J Natl Cancer Inst 2011; 103: 1827–1839
9. Rushton L, Hutchings SJ, Fortunato L, et al. Occupational cancer burden in Great Britain. Br J Cancer 2012; 107: Suppl 1, S3–S7
10. Boffetta P, Autier P, Boniol M, et al. An estimate of cancers attributable to occupational exposures in France. J Occup Environ Med 2010; 52: 399–406
11. Loomis D, Huang W, Chen G. The International Agency for Research on Cancer (IARC) evaluation of the carcinogenicity of outdoor air pollution: focus on China. Chin J Cancer 2014; 33: 189–196
12. Lim WY, Seow A. Biomas fuels and lung cancer. Respirology (Carlton Vic). 2012;17(1):20-31
13. Yang IA, HollowayJW, FongKM. Genetic susceptibility to lung cancer and co-morbidities. J Thorac Dis.2013;5(Suppl 5):S454-S462
14. Larsen JE, MinnaD. Molecular biology of lung cancer: clinical implications. Clinics in Chest Medicine.2011;32(4):703-740
15. Amos CI, Wu X, Broderick P, et al. Genome-wide association scan of tag SNPs identifies a susceptibility locus for lung cancer at 15q25.1. Nat Genet 2008; 40: 616–622
16. Shim J, Brindle L, Simon M, George S. A systematic review of symptomatic diagnosis of lung cancer. Fam Pract 2014; 31(2):137–148
17. Lung Carcinoma: Tumors of the Lungs. Merck Manual Professional Edition. Online edition. Retrieved 15th August 2007
18. Bradley SH, Abraham S, Callister ME, Grice A, Hamilton WT, Lopez RR, Shinkins B, Neal RD. Sensitivity of chest X-ray for detecting lung cancer in people presenting with symptoms: a systematic review. Br J Gen Pract. 2019;69(689):e827-e835
19. Mazzone PJ, Silvestri GA, Patel S et al. Screening for lung cancer: chest guideline and expert panel report. Chest 2018;153(4):954–985b 20. Sasaki R, Komaki R, Macapinlac H, et al. 18 fluorodeoxyglucose uptake by positron emission tomography predicts outcome of non-small-cell lung cancer. J Clin Oncol 2005; 23:1136–1143
21. Shao X, Niu R, Jiang Z, Shao X, Wang Y. Role of PET/CT in Management of Early Lung Adenocarcinoma. American Journal of Roentgenology. 2020;214: 437-445
22. Taylor SA, Mallett S, Ball S, et al. Diagnostic accuracy of whole-body MRI versus standard imaging pathways for metastatic disease in newly diagnosed non-small-cell lung cancer: the prospective Streamline L trial. Lancet Respir Med. 2019; 7(6):523-532
23. Rivera MP, Mehta AC, Wahidi MM. Establishing the diagnosis of lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013;143:e142S-65S
24. Korevaar DA, Crombag LM, Cohen JF, Spijker R, Bossuyt PM, Annema JT. Added value of combined endobronchial and oesophageal endosonography for mediastinal nodal staging in lung cancer: a systematic review and meta-analysis. Lancet Respir Med 2016; 4: 960–68
25. Ost DE, Ernst A, Lei X et al. Diagnostic yield and complications of bronchoscopy for peripheral lung lesions. Results of the Acquire Registry. Am J Respir Crit Care Med 2016; 193: 68–77
26. Epelbaum O, Aronow WS. Autofluorescence bronchoscopy for lung cancer screening: a time to reflect. Ann Transl Med. 2016;4(16):311
27. Iftikhar IH, Musani AI. Narrow-band imaging bronchoscopy in the detection of premalignant airway lesions: a meta-analysis of diagnostic test accuracy. Ther Adv Respir Dis 2015;9:207-16
28. Zaric B, Perin B, Stojsic V, et al. Relation between vascular patterns visualized by Narrow Band Imaging (NBI) videobronchoscopy and histological type of lung cancer. Med Oncol 2013;30:374
29. Shibuya K, Hoshino H, Chiyo M, et al. Subepithelial vascular patterns in bronchial dysplasias using a high magnification bronchovideoscope. Thorax 2002;57:902-7
30. Lam S, Standish B, Baldwin C, et al. In vivo optical coherence tomography imaging of preinvasive bronchial lesions. Clin Cancer Res 2008;14:2006-11
31. Hariri LP, Mino-Kenudson M, Lanuti M, et al. Diagnosing lung carcinomas with optical coherence tomography. Ann Am Thorac Soc 2015;12:193-201
32. Thiberville L, Salaün M, Lachkar S, et al. Human in vivo fluorescence microimaging of the alveolar ducts and sacs during bronchoscopy. Eur Respir J 2009;33:974-85
33. Wellikoff AS, Holladay RC, Downie GH, et al. Comparison of in vivo probe-based confocal laser endomicroscopy with histopathology in lung cancer: A move toward optical biopsy. Respirology 2015;20:967-74
34. Short MA, Lam S, McWilliams AM, et al. Using laser Raman spectroscopy to reduce false positives of autofluorescence bronchoscopies: a pilot study. J Thorac Oncol 2011;6:1206-14
35. Feng SH, Yang ST. The new 8th TNM staging system of lung cancer and its potential imaging interpretation pitfalls and limitations with CT image demonstrations. DiagnInterv Radiol. 2019;25(4):270-279
36. Travis WD, Brambilla E, Nicholson AG, Yatabe Y, Austin JH, Beasley MB, Chirieac L, Dacic S, Duhig E, Flieder DB, et al.; WHO Panel. The 2015 World Health Organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification. J Thorac Oncol 2015;10:1243–1260
37. Inamura K. Update on Immunohistochemistry for the Diagnosis of Lung Cancer. Cancers (Basel). 2018;10(3):72
38. Pikor LA, Ramnarine VR, Lam S, et al. Genetic alterations defining NSCLC subtypes and their therapeutic implications. Lung Cancer 2013;82:179-89
39. Zhang YL, Yuan JQ, Wang KF, et al. The prevalence of EGFR mutation in patients with non-small cell lung cancer:a systematic review and meta-analysis. Oncotarget 2016;7:78985-93
40. Li T, Kung HJ, Mack PC, et al. Genotyping and genomic profiling of non-small-cell lung cancer: implications for current and future therapies. J Clin Oncol 2013;31:1039-49
41. Lindeman NI, Cagle PT, Aisner DL, et al. Updated molecular testing guideline for the selection of lung cancer patients for treatment with targeted tyrosine kinase inhibitors:
guideline from the College of American Pathologists, the International Association for the Study of Lung Cancer, and the Association for Molecular Pathology. Arch Pathol Lab Med 2018;142:321-46
42. Reck M, Rodriguez-Abreu D, Robinson AG et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016; 375: 1823–1833 43. Leighl NB, Page RD, Raymond VM, et al. Clinical utility of comprehensive cell-free DNA analysis to identify genomic biomarkers in patients with newly diagnosed metastatic non-small cell lung cancer. Clin Cancer Res 2019;25(15):4691–4700
44. Rolfo C, Mack PC, Scagliotti GV, et al. Liquid biopsy for advanced Non-Small Cell Lung Cancer (NSCLC): A statement paper from the IASLC. J Thorac Oncol 2018;13(9):1248–1268
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe