
Imuno-oncologia reprezintă un domeniu de viitor pentru cercetarea în oncologie.
 Descoperirile din acest domeniu au determinat o schimbare de paradigmă în ceea ce privește evaluarea și tratamentul pacienţilor cu neoplazii în stadii avansate, dar și un pas înainte în domeniul medicinei personalizate.
Descoperirile din acest domeniu au determinat o schimbare de paradigmă în ceea ce privește evaluarea și tratamentul pacienţilor cu neoplazii în stadii avansate, dar și un pas înainte în domeniul medicinei personalizate.
Numeroase studii arată că diferite tipuri de cancer sunt caracterizate prin prezenţa unui bogat infiltrat cu celule ale sistemului imun. S-a dovedit că prezenţa celulelor sistemului imun reprezintă un factor de prognostic favorabil în evoluţia cancerului, dar care este dependent de subtipul neoplaziei. Acesta a fost un motiv în plus care a impus necesitatea realizării unei stratificări în pași în evaluarea cancerului, care să permită personalizarea tratamentului în funcţie de diferite criterii, printre care și particularităţile imunologice. O altă implicaţie ar fi că stimularea imunităţii prin activitate fizică poate fi benefică pentru a preveni recurenţa în cancerul de sân, de exemplu, însă dovezile știinţifice sunt insuficiente în acest sens.
Un alt rol-cheie în oncologie îl deţin receptorii hormonali. Studiile au arătat că receptorii hormonali sunt regăsiţi nu doar în cancerul de sân și în cel ovarian, ci și în cel de vezică urinară sau cel pulmonar. De aceea, una dintre opţiunile terapeutice disponibile la ora actuală este tratamentul „antihormonal”. Pentru determinarea receptorilor hormonali în cancerul de sân există două tipuri de sisteme de teste: Endopredict și Mammatyper, utilizate pentru subtipare, pentru a identifica riscul în neoplasmele mamare de tip luminal.
În tratamentul cancerului de vezică urinară au fost aprobate noi molecule: pembrolizumab, nivolumab. Sunt terapii anti PD-1, cu indicaţie pentru terapia de linie a doua la pacienţii cu metastaze la care chimioterapia nu a fost eficientă. Pentru a administra aceste medicamente, trebuie evaluaţi obligatoriu PD-L1. PD-1 (programmed cell-death 1) este un receptor exprimat la nivelul celulelor T, receptor de tip „off”, care împiedică celula T să atace structurile organismului. PD-1 se leagă de ligandul PD-1 (PD-L1), care se regăsește la nivelul celulelor normale ale organismului. Această legare acţionează ca un „punct de control” (check-point), împiedicând atacul sistemului imun și, implicit, apariţia fenomenelor de autoimunitate. Anumite celule canceroase exprimă și ele pe suprafaţă PD-L1, ca mecanism de apărare ce previne activarea celulelor T, evitând deci atacurile sistemului imun. De reţinut este că expresia PD-L1 crește în carcinoamele avansate și agresive, dar ea poate fi asociată cu șanse mai mari de răspuns la tratament (însă studiile de fază III nu au arătat că PD-L1 ar fi un marker predictiv și de încredere).
Acum câteva luni, a fost aprobat pentru utilizare în tratamentul cancerului de sân medicamentul atezolizumab, un anticorp monoclonal anti PD-L1, indicat doar pacientelor diagnosticate cu neoplasm de sân triplu negativ (adică negativ pentru receptorii de estrogen și progesteron și pentru proteinele HER2) și pozitiv pentru PD-L1, însă nu este momentan aprobat pentru cazurile cu metastaze.
În neoplasmele de sân de tip luminal cu receptori de estrogen pozitivi trebuie căutate elementele de proliferare, dar și modificările sistemului imun. Neoplasmele de sân de tip luminal sunt de două tipuri: tip A (cu receptori hormonali pozitivi – estrogenici și/sau progesteronici, HER2 negativ și cu niveluri reduse de proteină Ki67, care determină o evoluţie lentă și un prognostic pozitiv) și tip B (cu receptori hormonali pozitivi – estrogenici și/sau progesteronici, HER2 negativ sau pozitiv și cu niveluri crescute de proteină Ki67). 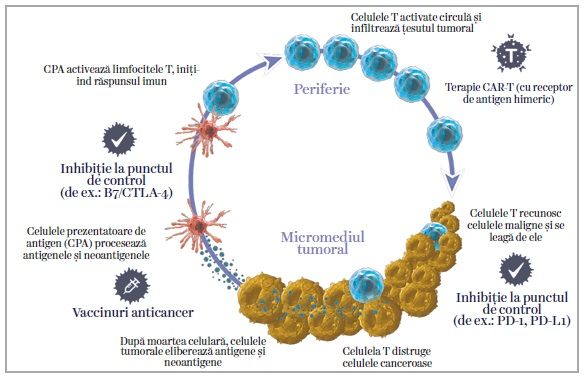
Distincţia dintre neoplasmele luminale de tip A și cele de tip B este importantă pentru alegerea terapiei corespunzătoare. Neoplasmele de tip luminal de tip A nu necesită chimioterapie. În cele de tip B se poate apela la chimioterapie sau imunoterapie sau la o combinaţie între cele două.
În tumorile cu receptori hormonali pozitivi nu trebuie evaluată doar expresia receptorului în sine, ci este importantă și cuantificarea calitativă și cantitativă a receptorului prezent. De asemenea, în funcţie de cantitatea HER2 prezentă, se poate indica beneficiul unei medicaţii cu dublă inhibiţie la nivelul acestui receptor. La fel, în carcinomul mamar triplu negativ este importantă evidenţierea PD-L1, doar tumorile PD-L1 pozitive putând beneficia de terapii de tip „check-point”.
Cuantificarea PD-L1 este destul de dificilă, în prezent existând patru tipuri de modele analitice și patru tipuri de anticorpi pentru tratament. Noile descoperiri ale cercetătorilor sunt pe punctul de a fi introduse în ghiduri, anumite teste fiind în prezent evaluate în cadrul unor studii prospective, pentru a obţine nivelul de evidenţă I A.
Metodele de laborator utilizate pentru a efectua aceste teste moleculare sunt importante. În prezent, costurile pentru efectuarea lor au scăzut. În plus, beneficiul pacienţilor este uriaș, după efectuarea acestor evaluări fiind indicate tratamente ţintite, personalizate. Un test de imunohistochimie costă acum între 70 de euro și 110 euro, la fel și un test molecular, iar costurile imunoterapiei ţintite se ridică la 4.000 de euro lunar. Testele de înaltă performanţă pot fi cost-eficiente și pot crește considerabil șansele vindecării pacienţilor.
Se încearcă acum în oncologie ca vechile terapii, implicit chimioterapia clasică, să fie combinate cu noile molecule – inhibitorii punctelor de control. Astfel este afectată tumora, antigenele tumorale sunt expuse, iar sistemul imun poate identifica și ataca celulele maligne. Această combinaţie pare să fie mult mai eficientă. Este clar că și o combinaţie de două–trei molecule noi poate fi mult mai eficientă decât o singură moleculă și astfel se poate crește calitatea vieţii pacientului.
Tehnicile alternative de diagnostic și îngrijirile pe termen lung reprezintă o provocare pentru specialiști. Creșterea calităţii vieţii și susţinerea psihologică a pacientelor diagnosticate cu neoplasm mamar sunt obiective prioritare. În general, pentru monitorizare se utilizează markerii CA-15-3, CA-19-9, CEA, iar medicii iau în considerare doar valoarea absolută a acestora. Cercetătorul german Ralph Wirtz (CEO & CSO Stratifyer Molecular Pathology GmbH) consideră că acesta este un mod eronat de evaluare. Un studiu efectuat alături de echipa sa pe un lot de 800 de paciente urmărite pe o perioadă de zece ani a arătat că metoda corectă de monitorizare constă în măsurarea valorii bazale a acestor markeri, imediat după chirurgie, radioterapie, chimioterapie etc., apoi se repetă testarea după șase luni, iar ulterior se recoltează de încă două ori, la interval de șase săptămâni. Dacă se înregistrează o creștere substanţială a valorilor markerilor, atunci pacienţii vor fi retestaţi după o săptămână, pentru a îndepărta orice urmă de eroare. Astfel putem obţine o specificitate și sensibilitate bune pentru a detecta metastazarea precoce.
Potrivit specialistului, cele mai recente studii clinice care urmăreau monitorizarea postterapie primară (chirurgie, radioterapie, chimioterapie etc.) a pacienţilor au fost realizate acum 30 de ani. Pe atunci nu existau toate opţiunile terapeutice de acum și nici posibilităţile tehnice avansate pentru a elimina metastazele hepatice, pulmonare etc. Este foarte important ca în cazul acestor pacienţi să fie cunoscut subtipul neoplaziei. Terapia primară este dependentă de acesta, însă nu și monitorizarea ulterioară.
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe