
Hematologia modernă a cunoscut progrese însemnate în ultimele două decade, ce se asociază cu un număr considerabil și în continuă creștere a parametrilor biologici și imagistici furnizaţi.
Hematologia modernă a cunoscut progrese însemnate în ultimele două decade, ce se asociază cu un număr considerabil și în continuă creștere a parametrilor biologici și imagistici furnizaţi de o tehnologie tot mai performantă. Aceste date necesită o prelucrare pe cât de complexă, pe atât de rapidă, ceea ce face din domeniu unul atrăgător pentru aplicaţiile IA.
Inteligenţa artificială (IA) poate fi definită „ca un sistem de programe de calculator care are capacitatea de a interpreta corect datele externe, de a învăţa din ele și de a folosi tot ce a învăţat pentru a-și atinge obiectivele și sarcinile, printr-o abordare flexibilă” – sau, mai simplu spus, ca „inteligenţa” mașinilor de calcul.
Ea a apărut ca domeniu de cercetare și academic în anii ’50, cunoscând de atunci un interes crescând, dar cu oscilaţii, domeniul înregistrând un salt semnificativ în ultima decadă.
Are la bază procesul de învăţare de către calculatoare a algoritmilor (set de instrucţiuni succesive realizate iniţial de om pentru prelucrarea unui anume pachet de date), elaboraţi pentru rezolvarea unor probleme sau situaţii specifice prin crearea de „modele” de lucru, care sunt perfecţionate prin antrenamente și reantrenamente ce constau din testări repetate până la obţinerea unui rezultat considerat optim.
Se admite că IA combină două proprietăţi, respectiv autoînvăţarea prin procesări succesive și repetitive ale datelor furnizate și capacitatea de adaptare, adică posibilitatea ca un program elaborat să facă faţă unor situaţii multiple, care pot varia în timp.
IA a pătruns ca un însemnat ajutor al omului în variate domenii, inclusiv în medicină, unde a primit denumirea generică de „IA medicală”.
În cazul medicinei, premisa care a stat la bază a fost aceea că faţă de modul tradiţional de abordare a unui pacient aflat într-o anumită situaţie clinică, bazat pe reguli prestabilite, anteprogramate, în învăţarea automată sistemul învaţă din exemplele care îi sunt furnizate, de regulă cu mult mai numeroase decât cele ce pot fi asimilate de un medic în practica medicală curentă, și emite rezultate în timp scurt.
Pe de altă parte, medicina s-a văzut în faţa unei provocări, aceea a volumului enorm și în creștere exponenţială a datelor furnizate de medicina clinică, medicina de laborator și de cercetarea biomedicală, volum de date care a devenit, și prin complexitate, imposibil de prelucrat. A apărut astfel în medicină o situaţie aparent paradoxală, de „bogăţie de date, dar informaţie puţină” („data rich, information poor”, DRIP), impas ce se consideră că ar putea fi depășit cu ajutorul IA.
IA medicală s-a organizat prin elaborarea unor acte normative menite să introducă termeni adecvaţi, definiţii și reglementări pentru asigurarea atât a unei mai largi utilizări, cât și a unui echilibru între siguranţă și inovaţie în acest domeniu.
Forul Internaţional de Reglementare a Dispozitivelor Medicale a recunoscut complexul de programe de calculator al IA drept un dispozitiv medical de sine stătător, de natură non-fizică (Software as a Medical Device, SaMD), un instrument nou, diferit de cel inclus ca o componentă în alte dispozitive medicale utilizate în practică sau în aparatele folosite pentru testarea, întreţinerea, repararea acestora.
SaMD este de fapt o tehnologie ce constă din aplicaţii derulabile pe calculator, capabilă să proceseze cu discernământ o cantitate de date ce depășește capacitatea creierului uman de a o cuprinde și să ofere soluţii bazate pe această prelucrare. FDA (Food and Drug Administration) a recunoscut SaMD ca instrument ce ajută personalul medical în actul decizional și a elaborat în 2019 un ghid pentru reglementarea utilizării lui.
Agenţia Europeană a Medicamentului (EMA) a procedat asemănător prin emiterea „Regulation EU 2017/745”, cu aplicare din mai 2020.
Ponderea utilizării IA medicale în practica curentă a crescut continuu în SUA și Comunitatea Europeană (Fig. 1), numai în ultimii doi ani fiind aprobate de FDA cca. 33 de produse care folosesc elemente ale IA aplicabile în variate boli și situaţii clinice.
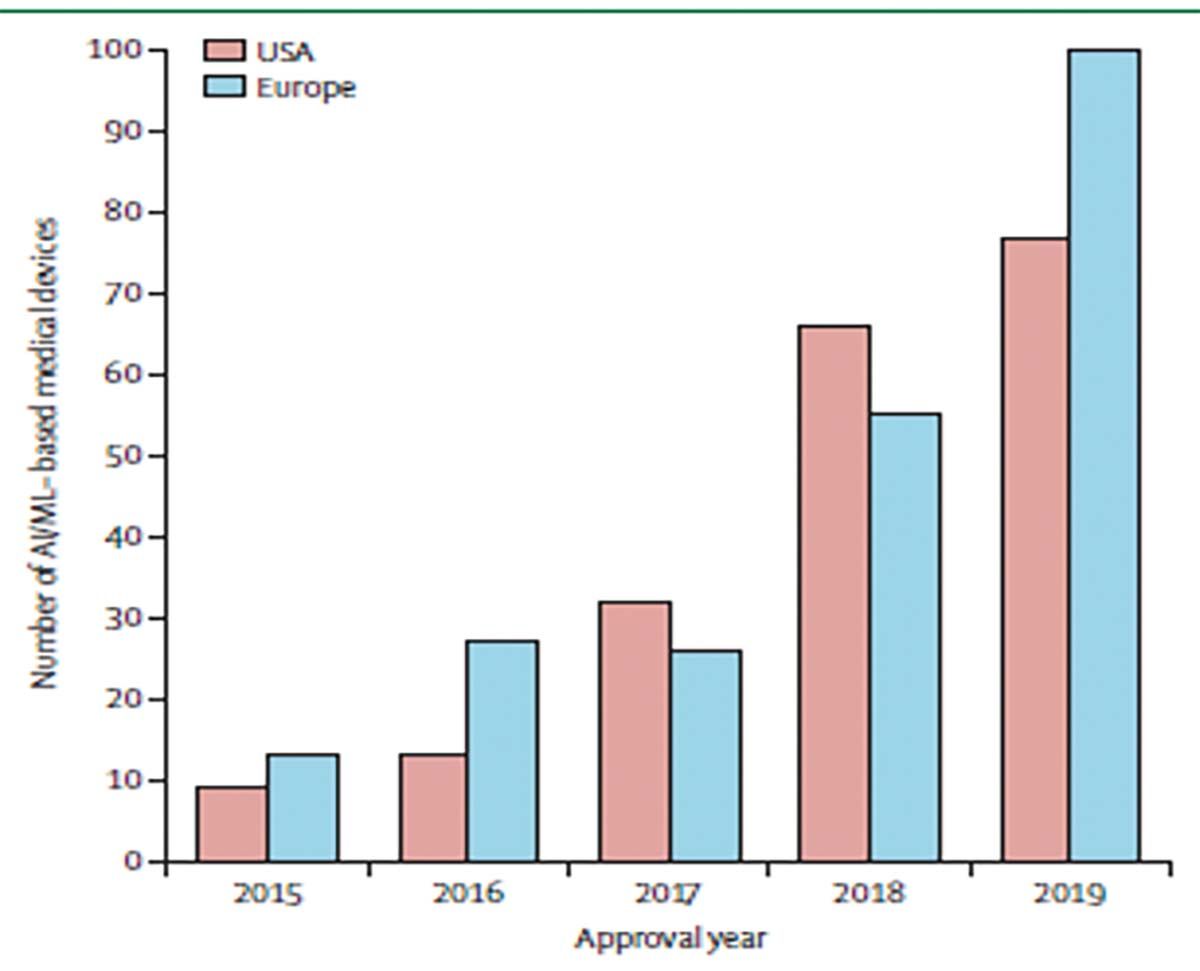
Totuși, numai 44% dintre medicii din SUA declară că ar folosi sau ar intenţiona să folosească IA în activitatea lor. Trebuie totodată menţionat că nu a fost încă emis de către FDA sau EMA un set de criterii precise și stricte, ci numai relative, pe care trebuie să le îndeplinească un dispozitiv pentru a fi aprobat ca SaMD pentru utilizare în practică.
Hematologia modernă a cunoscut progrese însemnate în ultimele două decade și aceasta s-a asociat cu un număr considerabil și în continuă creștere a parametrilor biologici și imagistici furnizaţi de o tehnologie tot mai performantă. Aceste date necesită o prelucrare pe cât de complexă, pe atât de rapidă, ceea ce face din acest domeniu unul atrăgător pentru
aplicaţiile IA.
În ultimii trei ani au apărut mai multe articole cu caracter general care se ocupă de aplicaţii ale IA în domeniul hematologiei, o parte dintre concluziile acestora fiind menţionate în cele ce urmează. În hematologie se aplică o subramură a IA denumită machine learning, ML (învăţare automată), și subdomeniul acesteia, denumit deep learning, DL (învăţare aprofundată).
ML este definită ca un ansamblu de programe (matematice și logice) care, în loc de a fi antecreate ca să îndeplinească un anumit obiectiv plecând de la o serie de date, se autoajustează (modifică) automat, pe măsură ce sunt expuse la tot mai multe astfel de date, pe care le analizează și le interpretează, învăţând din ele și din experienţa lucrului cu ele, pentru a-și îmbunătăţi performanţa în realizarea acelui obiectiv.
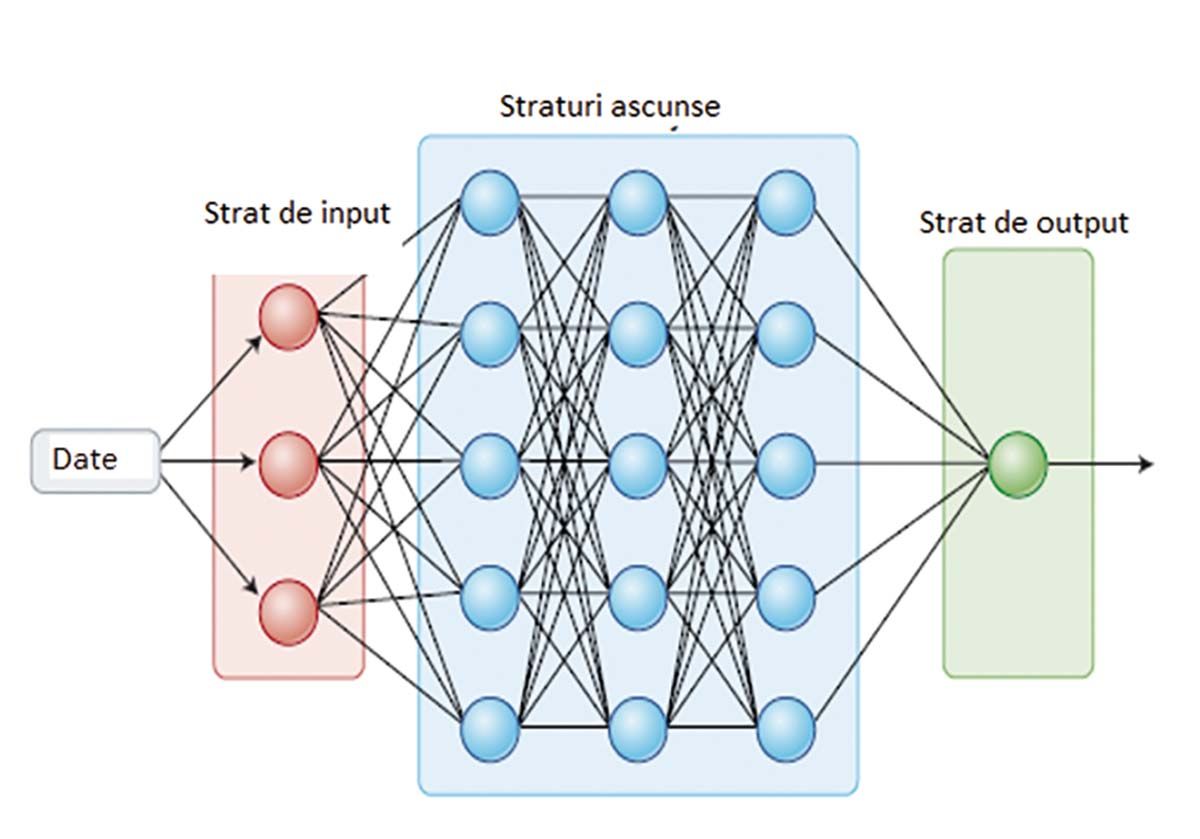
ML permite astfel identificarea automată a unor tipare și realizarea de asocieri între acestea. DL constituie un subdomeniu mai avansat în cadrul ML. Acesta folosește straturi multiple de reţele neuronale artificiale (Fig. 2 și 3), al căror număr definește gradul de profunzime, straturi ce reproduc modul de funcţionare a reţelelor neuronale umane.
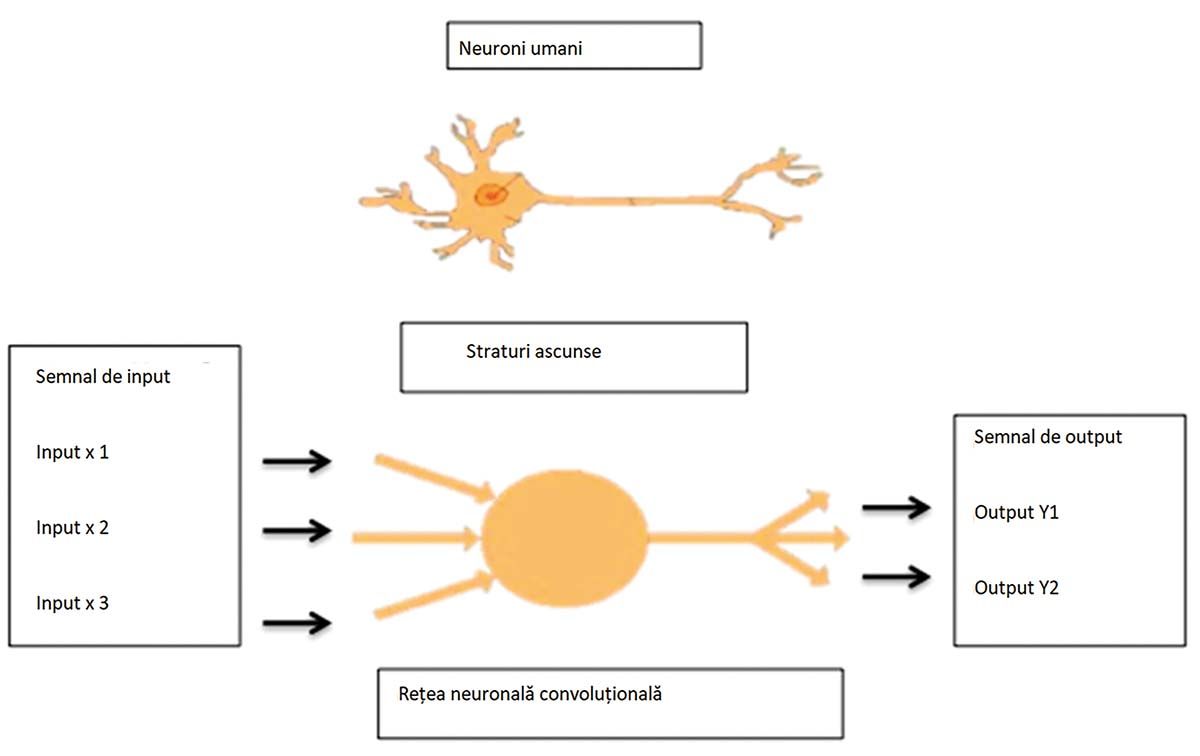
Astfel, permite extragerea automată a trăsăturilor reprezentărilor fără ca acestea să fie marcate în prealabil, având capacitatea prelucrării unui volum mult mai mare de informaţii și de a învăţa din erori fără intervenţie umană.
Iniţiată în 1995, utilizarea IA în hematologie s-a făcut în mai toate domeniile acesteia (Fig. 4), cu precădere în hematomorfologie, unde s-a concretizat în produse ce au îndeplinit cerinţele FDA și EMA pentru comercializare.
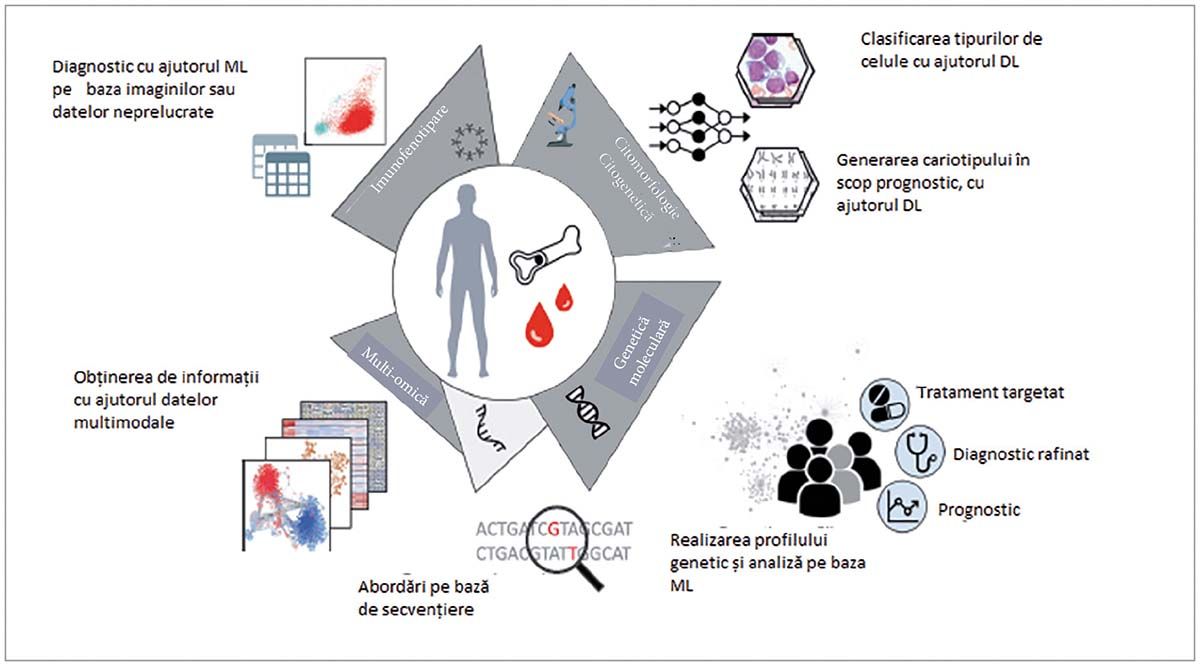
a) Aplicaţii în hematocitologie
Examenul citomorfologic al sângelui periferic și al măduvei osoase efectuat pe frotiuri întinse pe lame de sticlă a constituit timp de peste 150 de ani coloana vertebrală a diagnosticului în bolile hematologice, și aceasta este situaţia și în prezent, el constituind punctul de plecare, de orientare, indispensabil pentru alte investigaţii.
Acest examen de laborator presupune însă un volum mare de lucru, fiind efectuat manual, necesitând personal specializat și antrenat, reproductibilitatea rezultatelor între laboratoare putând fi influenţată de experienţa, aptitudinile și gradul de performanţă ale celor implicaţi.
Se speră că prelucrarea digitală a imaginilor microscopice, procesarea automată a acestora și analiza și clasificarea computerizată vor permite efectuarea automată a evaluării diferenţiate, cantitativă și calitativă, a elementelor figurate din sângele periferic și chiar din măduva osoasă, și identificarea diverselor celule și aspecte patologice.
În acest scop, au fost create de-a lungul timpului mai multe analizoare automate de imagini digitale ale elementelor figurate de pe frotiul de sânge periferic, cele mai cunoscute fiind CellaVision AB și ARBA, Suedia, și Sysmex XN, Japonia.
În esenţă, ele constau dintr-un microscop performant la care s-a atașat o cameră fotografică de înaltă calitate, un scanner, un mecanism de deplasare automată controlată a lamelor, un calculator și un soft care clasifică celulele, soft alcătuit din algoritmi construiţi folosind sistemul DL.
Ele stau la baza noului subdomeniu denumit „hematologie digitală”, aflat sub jurisdicţia profesională a mai multor organisme internaţionale de profil, precum Comitetul Internaţional pentru Standardizare în Hematologie – CISH (include și un grup de lucru pentru imagini digitale), care emit cerinţe și recomandări pentru validare.
De menţionat însă că, deși aflate în utilizare de mai mulţi ani și în continuă perfecţionare, analizoarele automate de imagini digitale ale celulelor sanguine au pătruns destul de puţin în laboratoarele de hematologie, pentru moment locul lor recomandat fiind cel al laboratoarelor cu volum mic/mediu de lucru, din unităţi cu patologie generală, pentru efectuarea examinărilor de rutină.
Chiar și așa, analizorul nu lucrează independent, se impune prezenţa unui specialist hematocitomorfolog, care intervine pentru supervizare, validarea permanentă a rezultatelor și elucidarea situaţiilor incerte. Principalele avantaje și limite ale analizoarelor existente sunt sintetizate în tabel.
Recent, CISH a făcut o analiză a performanţei mai multor analizoare de imagini digitale și a emis o serie de propuneri și recomandări pentru îmbunătăţirea lor și a activităţii în domeniu.
Au fost create analizoare (Vision Bone Marrow, Scorpio Full Field BMA) considerate apte de a recunoaște și celulele măduvei osoase, dar rezultatele sunt mai puţin promiţătoare, îndeosebi ca urmare a densităţii mari a celulelor și dispunerii variabile a acestora, ceea ce reduce mult din precizia rezultatului.
Totuși, foarte recent au fost publicate de către un grup de cercetători chinezi rezultate promiţătoare obţinute cu ajutorul unui produs, considerat primul de acest fel, capabil să ofere un buletin de analiză de „medulogramă” validat de către un studiu pilot.
b) Aplicaţii în hematopatologie
În domeniul hematopatologiei, FDA a aprobat în 2017 comercializarea primului sistem de examinare a imaginilor preparatelor histopatologice de măduvă osoasă, ganglion limfatic, splină și alte organe, mărite de 400 de ori și transpuse în format digital, denumit whole slide imaging (WSI).
S-a realizat astfel cu ajutorul tehnicilor de ML și DL un subdomeniu numit „patologia digitală”, al cărui deziderat este acela de a permite un diagnostic anatomopatologic cu acurateţe similară cu cea a examinării clasice a preparatelor pe lamă de sticlă, având avantajul facilitării atât în ceea ce privește stocarea preparatelor pentru reexaminări, pentru utilizare în studii și învăţământ, cât și trimiterea lor la distanţă între
laboratoare.
Totuși, aplicarea acestei tehnologii în practica hematopatologică de rutină este încă limitată la teleconsulturi, pentru a doua opinie, de exemplu, deoarece, pe de o parte, necesită supervizarea de către un specialist anatomopatolog experimentat, iar pe de alta, echipamentele existente nu sunt standardizate.
Mai mult, acurateţea rezultatelor este încă un subiect de controverse. Evaluări precum cele ale densităţii celulare au produs concordanţe cu examinarea clasică de numai 81%, identificarea automată a limfoblaștilor și a mieloblaștilor a fost făcută la numai 75% și, respectiv, 82% dintre probe în unele studii, cu rezultate mai bune în diferenţierea limfocitelor (concordanţă de 91%).
Rezultate considerate promiţătoare au fost obţinute în patologia limfoamelor, de exemplu o bună clasificare în gradul 1-3 bazată pe numărarea centroblaștilor în limfoamele foliculare, sau în evidenţierea imunohistochimică a unor markeri de limfocit B, care însă nu a depășit 87%, sau clasificarea limfoamelor cu celule mari de tip B în „centru germinativ” sau „non-centru germinativ”, care nu a depășit însă concordanţa de 91%. Se poate conchide că, în prezent, sistemul WSI și patologia digitală nu permit un diagnostic hematopatologic automat de certitudine.
Tabel: Principalele avantaje și limite ale analizoarelor de imagini digitale în hematologie
Avantaje
Imaginile pot fi ușor arhivate fără a se degrada în timp;
Imaginile pot suferi procesări adiţionale, adnotări sau analize prin vizualizare în grup;
Imaginile unor celule rare pot fi stocate și utilizate în comunicări, sunt facilitate educaţia și antrenamentul în hematomorfologie;
Este posibilă stocarea imaginilor împreună cu datele medicale ale pacienţilor respectivi;
Se reduc oboseala și solicitarea oculară ale examinatorilor;
Sunt facilitate controlul calităţii și consultul cu un coleg sau expert aflat la distanţă.
Limitări
În opinia unor specialiști, calitatea imaginilor digitale este încă inferioară celei a imaginilor obţinute direct la un microscop optic de bună calitate;
Reexaminarea manuală a frotiurilor este încă necesară în proporţie de 10-20% dintre probe;
Nu se recomandă utilizarea în examinarea sângelui de nou-născut;
Dificultăţi în evidenţierea anumitor celule ca: tipurile de blaști, plasmocite, granulocite imature, bazofile, monocite, precum și a modificărilor displazice;
Dificultăţi în evaluarea schizocitelor (eritrocite fragmentate) și a piriformelor (eritrocite în picătură), a paraziţilor intraeritrocitari (hematazoari), a aglutinatelor de eritrocite și de trombocite;
Examinare deficitară a marginilor și franjurilor frotiului de sânge;
Calitatea imaginilor este influenţată de calitatea frotiului, de metoda de obţinere a acestuia (manuală sau automatizată) și de coloranţii folosiţi;
Pentru o bună reproductibilitate a rezultatelor între laboratoare, este imperios necesară standardizarea echipamentelor.
Citește și: Inteligența artificială, un aliat în diagnosticul și tratamentul tulburărilor de somn
Bibliografie
1. Su-In Lee et al. A machine learning approach to integrate big data for precision medicine in acute myeloid leukemia. Nature Communications 2018,9:42
2. Rajkomar A. et al. Machine Learning in Medicine. N Engl J Med 2019;380:1347-58.
3. Radakovich N. et al. Artificial Intelligence in Hematology: Current Challenges and Opportunities. Current Hematologic Malignancy Reports https://doi.org/10.1007/s11899-020-00575-4
4. Walter W. et al. How artificial intelligence might disrupt diagnostics in hematology in the near future. Oncogene (2021) 40:4271–4280
5. El Achi H., Khoury J. D. Artificial Intelligence and Digital Microscopy Applications in Diagnostic Hematopathology. Cancers (Basel) 2020;12(4):797
6. Shouval R. et al. Machine learning and artificial intelligence in haematology. Brit j Haematol. 2020, doi: 10.1111/bjh.16915
7. Salah H.T. et al. Machine learning applications in the diagnosis of leukemia: Current trends and future directions. Int J Lab Hematol. 2019;41:717–725.
8. Sivapalaratnam S. Artificial intelligence and machine learning in haematology. British Journal of Haematology, 2019,185,207–208
9. Muhsen I.N. et al. Machine Learning Applications in the Diagnosis of Benign and Malignant Hematological Diseases. Clinical Hematology International 2021, 3(1):13–20
10. Kratz A. et al. Digital morphology analyzers in hematology: ICSH review and recommendations. Int J Lab Hematol 2019;41:437–447.
11. Hong Jin et al. Developing and Preliminary Validating an Automatic Cell Classification System for Bone Marrow Smears: a Pilot Study. Journal of Medical Systems 2020, 44:184
12. Hanna M.G. et al. Whole slide imaging equivalency and efficiency study: experience at a large academic center. Modern Pathology, doi.org/10.1038/s41379-019-0205-0.
13. El Achi H., Khoury J.D. Artificial Intelligence and Digital Microscopy Applications in Diagnostic Hematopathology. Cancers 2020, 12:797; doi:10.3390/cancers12040797
14. Muehlematter U.J. et al. Approval of artificial intelligence and machine learning-based medical devices in the USA and Europe (2015–20): a comparative analysis. Lancet Digit Health 2021;3:e195–203
15. Topol E.J. High-performance medicine: the convergence of human and artificial intelligence. Nature Medicine 2019,25: 44–56
16. Adoption of Artificial Intelligence and Machine Learning Is Increasing, but Irrational Exuberance Remains.. NEJM Catalyst Innovations in Care Delivery 2020;10.1056/CAT.19.1090
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe