
Agenția Europeană a Medicamentului (EMA) a făcut ieri un anunț referitor la medicamentul remdesivir. Astfel, agenția promite că va evalua datele noi provenite din studiul clinic „SOLIDARITY”.
Potrivit unui comunicat de presă preluat pe site-ul Agenției Naționale a Medicamentului și a Dispozitivelor Medicale din România, EMA a luat act de faptul că Organizația Mondială a Sănătății (OMS) și-a actualizat ghidurile care nu recomandă utilizarea remdesivirului la pacienții spitalizați cu COVID-19, indiferent de gravitatea bolii, stabilită pe baza unei meta-analize recente.
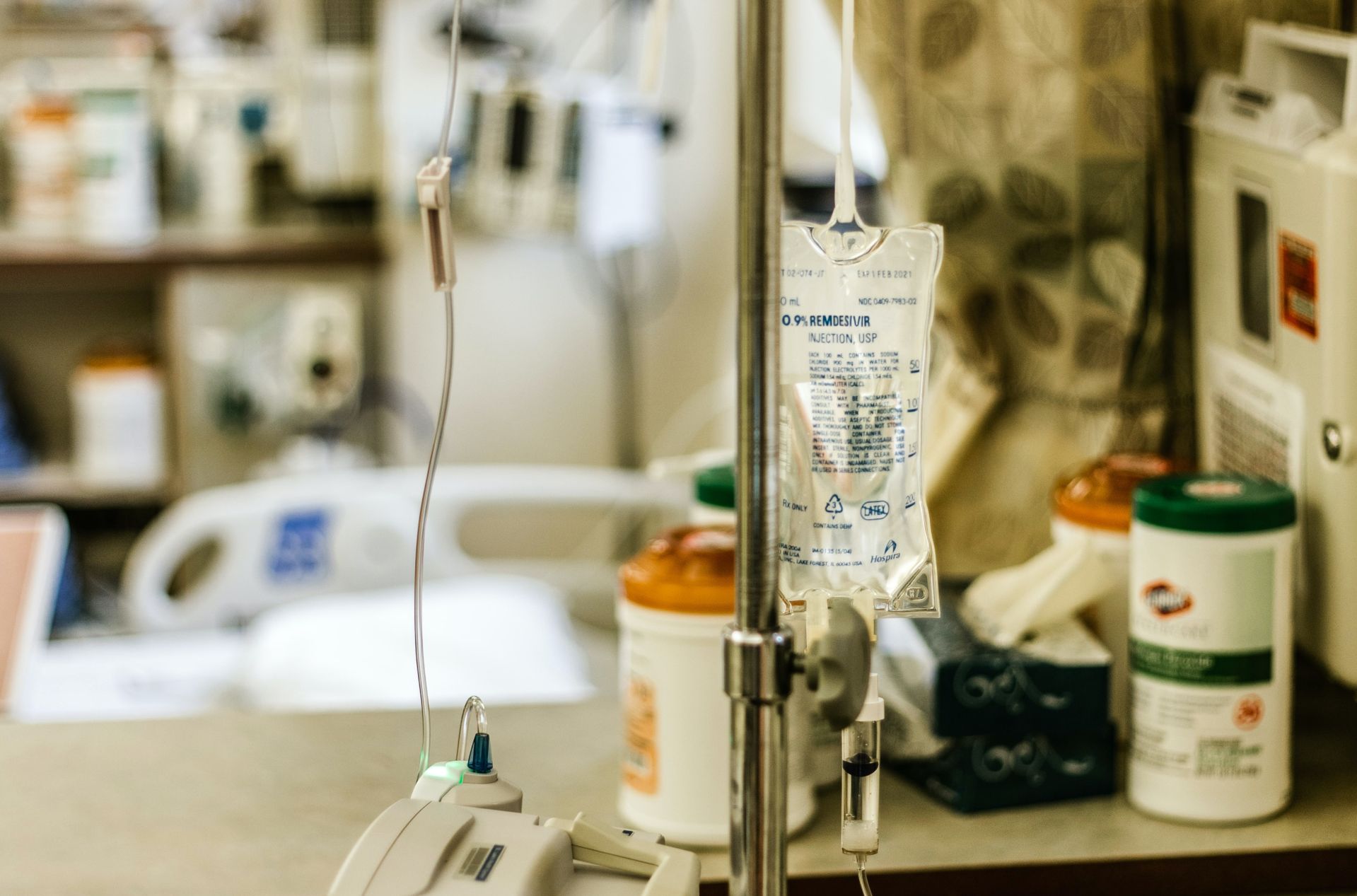
Remdesivir a fost autorizat în Uniunea Europeană în iulie 2020 prin produsul Veklury indicat în tratamentul infecției COVID-19 la adulți și adolescenți cu vârsta de 12 ani și peste, cu pneumonie, care necesită aport suplimentar de oxigen.
Veklury (remdesivir) a fost autorizat pe baza rezultatelor studiului clinic NIAID-ACTT-1, un studiu controlat randomizat care a implicat 1.063 pacienți spitalizați cu COVID-19 și care a arătat o îmbunătățire a intervalului până la recuperare, reducând timpul petrecut de pacienți în spital sau durata de tratament. Setul de date a fost publicat pe website-ul EMA, la secțiunea despre datele provenite din studii clinice.
V-ar putea interesa și: Reacția GILEAD Sciences în legătură cu recomandările OMS în privința remdesivir
La momentul autorizării, EMA a solicitat companiei să prezinte date suplimentare, inclusiv date referitoare la mortalitate, pentru a putea descrie mai bine eficacitatea și siguranța remdesivirului.
Datele privind mortalitatea din ziua 28 a studiului clinic NIAID-ACTT-1 au fost, de asemenea, disponibile recent și sunt în curs de examinare de către Committee for Medicinal Products for Human Use (CHMP).
Recomandarea OMS este condiționată(1) și se bazează pe o analiză sistematică și meta-analiză a patru studii randomizate cu 7.333 de persoane spitalizate cu COVID-19. Meta-analiza a inclus studiul clinic NIAID-ACTT-1 și studiul clinic „SOLIDARITY”.
Răspunsul dat de FDA după ce OMS a pus sub semnul întrebării eficiența remdesivir
Conform OMS, nivelul de certitudine al rezultatelor meta-analizei este scăzut, iar din dovezile existente nu a reieșit faptul că remdesivir nu ar avea beneficiile scontate. În vederea adoptării recomandărilor sale, OMS a luat în considerare și implicațiile asupra resurselor de sănătate, având în vedere costul remdesivirului, și necesitatea de administrare intravenoasă a acestuia.
OMS a recunoscut că sunt necesare mai multe cercetări, în special în anumite grupuri de pacienți, și a susținut înrolarea continuă în studiile clinicecare evaluează remdesivirul. Atunci când se utilizează remdesivir, profesioniștii din domeniul sănătății trebuie să urmeze informațiile autorizate despre medicament și să respecte cele mai recente ghiduri naționale de tratament.
V-ar putea interesa și: Remdesivir, nerecomandat în cazurile severe de COVID-19?
EMA a solicitat datele complete provenite din studiile clinice „SOLIDARITY” de la OMS și deținătorul autorizației de punere pe piață. Odată ce datele sunt disponibile, EMA va evalua dovezile, împreună cu alte informațiirelevante, pentru a vedea dacă sunt necesare modificări ale autorizației de punere pe piață pentru Veklury (remdesivir) în UE.
În ceea ce privește siguranța, remdesivirul este bine tolerat, cu o rată a posibilelor efecte adverse similară cu cea a remdesivirului și placebo (tratament dummy).
EMA evaluează în prezent un semnal de toxicitate renală, afecțiune care poate avea alte cauze, la pacienții cu COVID-19. EMA va comunica mai multe informații, după caz, se arată în finalul comunicatului.
(1) O recomandare condiționată este una pentru care Grupul OMS de elaborare a ghidurilor a concluzionat că efectele dezirabile ale aderării la recomandare depășesc probabil efectele nedorite, Grupul respectiv nefiind încrezător cu privire la aceste compromisuri.
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe