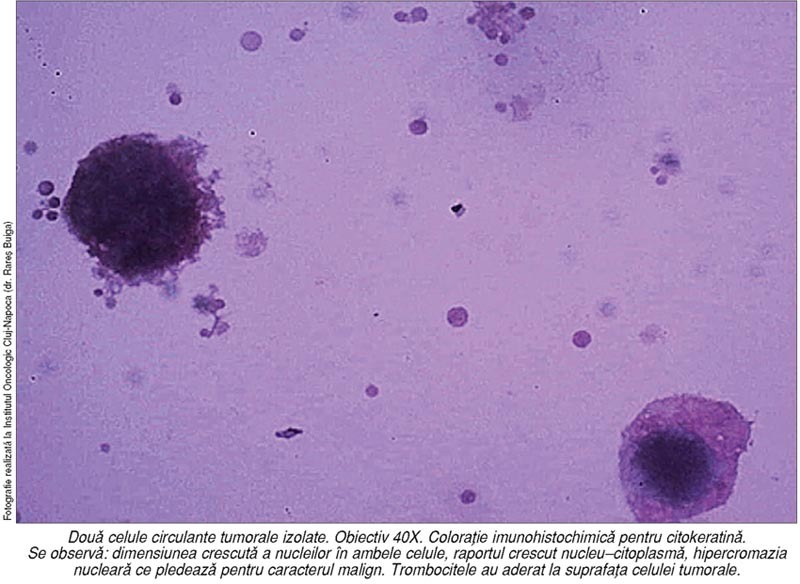
Celulele
tumorale circulante sunt celule tumorale izolate diseminate dintr-o tumoră
primară sau metastatică şi care pot fi identificate şi cuantificate în sângele
periferic al bolnavilor. Izolarea şi analiza acestor celule permite detectarea
precoce a metastazelor, procedeu mai puţin invaziv decât biopsia.
În
procesul de metastazare, celulele tumorale se detaşează din tumora primară şi
diseminează pe cale limfohematogenă la distanţă, o mare parte dintre acestea
fiind distruse în curentul sanguin. 0,01% din celulele circulante tumorale sunt
suficiente pentru a da naştere unei metastaze. Modele preclinice au demonstrat
că la 24 de ore de la injectarea intravenoasă a unui număr de celule tumorale,
mai puţin de 0,1% rămân viabile, dar sub 0,01% sunt capabile de metastazare. Aşadar,
numărul extrem de mic al acestor celule reprezintă o mare provocare în a le
identifica, cuantifica şi analiza.
Identificarea
celulelor tumorale circulante are o importantă implicaţie prognostică şi
terapeutică, deoarece acestea constituie un real biomarker predictiv şi
farmacodinamic, fiind utile în detectarea timpurie a recidivelor şi în
monitorizarea răspunsului la tratament. De asemenea, pot contribui la
selectarea pacienţilor pentru chimioterapia adjuvantă şi detectează profilurile
rezistente la tratament. Caracterizarea moleculară a acestor celule îmbunătăţeşte
procesul de cunoaştere şi înţelegere a mecanismului biologic tumoral şi
metastatic.
Criteriile
de identificare cuprind: prezenţa citoplasmei, membrana nucleară neregulată,
dimensiunea nucleului > 24 µm, anizonucleoză (raport > 0,5), raport
crescut nucleu-citoplasmă şi agregarea în grupuri celulare, hipercromazia
nucleară, prezenţa nucleolilor proeminenţi. Ţinând cont de aceste criterii, celulele
pot fi catalogate drept maligne când îndeplinesc patru criterii, cu potenţial
malign nedeterminat când îndeplinesc două criterii şi benigne când nu
îndeplinesc niciun criteriu. Pentru o corectă identificare s-au mai adăugat şi
alte criterii moleculare, cum ar fi pozitivitatea pentru anumite antigene de
suprafaţă.
În
prezent, se dezvoltă tehnici din ce în ce mai performante de detectare şi
analiză a acestor celule. Tehnicile actuale de detectare se bazează pe diferenţele
morfologice şi caracteristicile moleculare diferite faţă de celulele periferice
sanguine. Cerinţele esenţiale unei tehnici corecte sunt sensibilitate şi
specificitate mari.
Detecţia bazată pe
anticorpi împotriva unor antigene celulare. Celulele circulante tumorale au anumiţi
markeri de suprafaţă care lipsesc de pe celulele sanguine, cum ar fi EpCAM (epithelial cell adhesion molecule) care
este exprimat doar la nivelul celulelor cu provenienţă epitelială, fiind absent
în celulele din sânge.
Metoda
de separare imunomagnetică este cel mai des folosită în studiile clinice cu un
număr mare de pacienţi. Aceste sisteme folosesc microsfere acoperite cu
anticorpi anti-EpCAM care se ataşează de celulele tumorale care exprimă acest
antigen, fiind ulterior identificate pe baza acestei legături. După incubare,
spălare, separare magnetică şi fixare, celulele izolate sunt vizualizate şi numărate
prin microscopie automată digitală fluorescentă. Avantajele acestei metode sunt
reprezentate de o sensibilitate mare combinată cu o specificitate înaltă şi o bună
capacitate de a conserva celulele până la 96 de ore. Una din limitări este
aceea că expresia EpCAM este inconstantă şi suferă un proces de downregulation în celulele tumorale
diseminate din măduvă şi din sângele periferic.
Platformele
tehnologice de ultimă generaţie sunt astfel concepute pentru a caracteriza
celulele într-o manieră progresivă începând cu expresia proteinelor, apoptoza,
profilul molecular şi în final mutaţiile genetice.
Detecţia bazată pe
proprietăţile fizice. Există metode de separare pe baza proprietăţilor fizice
diferite ale acestor celule faţă de celulele sanguine. Acestea includ mărimea
mai mare, diferenţe de densitate şi de încărcătură energetică, precum şi
diferenţe în proprietăţile migratorii. O metodă bazată pe diferenţa dintre dimensiunile
unor astel de celule şi ale celorlalte elemente sanguine se numeşte ISET (isolation by size of epithelial tumor
cells). Aceasta realizează o separare mecanică a celulelor circulante
tumorale prin utilizarea unor filtre prevăzute cu pori cilindrici, menţinând
astfel integritatea celulelor şi permiţând analiza moleculară ulterioară a lor.
Prin
această tehnică pot fi identificate celule tumorale de la o mare varietate de
tumori (pulmonare, prostatice, mamare, hepatice, pancreatice, melanoame, glioblastoame)
atât sub formă de celule izolate, cât şi sub formă de agregate celulare
tumorale, necesitând o cantitate mică de sânge.
Detecţia bazată pe
acizii nucleici. Reacţia
de polimerizare în lanţ (PCR) este o metodă de amplificare enzimatică in vitro a unei anumite secvenţe de ADN
sau ARN a cărei structură nucleotidică este parţial cunoscută. În prezent, este
cea mai intens studiată metodă de detectare a celulelor circulante tumorale.
Apariţia tehnicii PCR a oferit o cale mai specifică şi mai sensibilă decât
tehnicile imunomagnetice pentru a distinge aceste celule pe baza diferenţelor
în expresia genelor şi a profilului genetic. Avantajele acestei tehnici constau
în rapiditate, eficacitate, sensibilitate crescută şi simplitate. Dezavantajele
sunt reprezentate de necesitatea unor informaţii prealabile despre secvenţa
capetelor terminale ale ADN-ului de replicat pentru a obţine oligonucleotidele
specifice, cantitatea limitată şi mărimea mică a produsului, precum şi apariţia
erorilor de împerechere care depind de precizia ADN polimerazei şi de
capacitatea de corecţie.
Aplicaţii clinice. Studiile recente s-au
concentrat pe identificarea celulelor circulante tumorale la bolnavii cu cancer
colorectal, mamar, pulmonar şi de prostată. Dintr-o probă de 7,5 ml de sânge se
pot număra celulele circulante tumorale la începutul terapiei antitumorale,
observându-se scăderea lor rapidă după iniţierea chimioterapiei sau
hormonoterapiei şi chiar atingerea unei limite nedetectabile în sânge la 24 de
ore după rezecţia chirurgicală a tumorii primare. Odată identificate şi
analizate, acestea sunt importante pentru stabilirea cât mai exactă a
prognosticului, reprezentând un biomarker farmacodinamic şi predictiv în răspunsul
la terapie. Prezenţa acestor celule în număr crescut în sângele pacienţilor
este corelată cu o rată de supravieţuire scăzută, confirmând valoarea
prognostică a acestora. Acestea se corelează cu rata de recidivă tumorală şi
intervalul liber de supravieţuire, precum şi cu răspunsul la terapia
antitumorală administrată.
Persistenţa
acestor celule în număr crescut pe perioada chimioterapiei permite
identificarea pacienţilor cu profil rezistent la tratament, fiind astfel scutiţi
de toxicitatea unui tratament inutil. Această analiză trebuie corelată cu alte
metode clinice de monitorizare a pacienţilor. Posibilitatea obţinerii acestei
analize în orice moment în cursul evoluţiei bolii permite evaluarea timpurie a
prognosticului pacientului şi reprezintă un factor predictiv precoce al
supravieţuirii. Aceste celule sunt un surogat al activităţii biologice
tumorale, permiţând astfel biopsia în timp real.
Cu
toate acestea, majoritatea metodelor folosite în prezent pentru detectarea
acestor celule nu sunt suficient de performante pentru stabilirea exactă a numărului
acestora. În schimb, urmărirea lor în dinamică după terminarea unei terapii
antitumorale poate detecta un cancer în stadiu incipient mult mai timpuriu decât
orice parametri clinici sau imagistici. Caracterizarea moleculară a celulelor
tumorale circulante oferă capacitatea unică de a evalua caracteristicile
genotipice şi fenotipice ale cancerului, fără necesitatea unei biopsii.
Odată
cu înţelegerea biologiei tumorale şi a căilor de semnalizare în formarea şi
progresia tumorii, devine tot mai clar că mecanismul de bază al terapiei
antitumorale trebuie adaptat caracteristicilor individuale tumorale, punându-se
bazele conceptului medicinii personalizate.
Mulţumiri: dr. Sergiu
Susman, Disciplina anatomie patologică, UMF „Iuliu Haţieganu“ Cluj-Napoca.