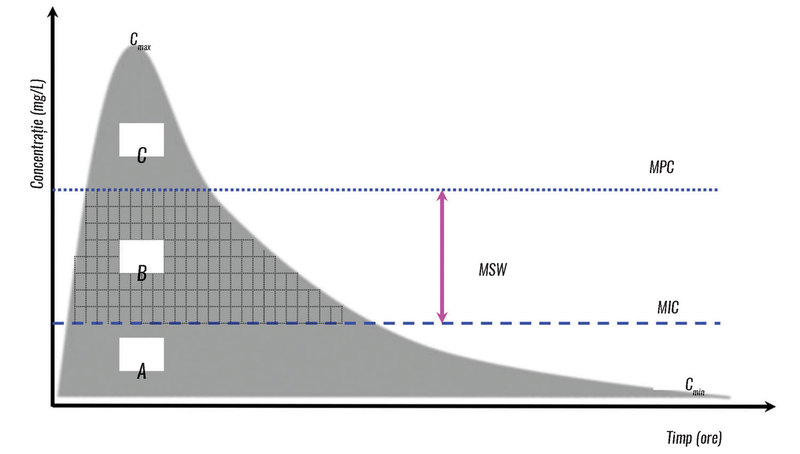
Farmacocinetica este modificată
Cât de profitabile sunt noile molecule
Bibliografie
1. Bassetti M et al. Light and shade of new antibiotics. Annual Update in Intensive Care and Emergency Medicine 2015. Springer International 2015: 63-85
2. Harris PN. Clinical management of infections caused by Enterobacteriaceae that express extended-spectrum β-lactamase and AmpC enzymes. Semin Respir Crit Care Med. 2015 Feb;36(1):56-73.
3. Doi Y, Paterson DL. Carbapenemase-producing Enterobacteriaceae. Semin Respir Crit Care Med. 2015 Feb;36(1):74-84
4. Doi Y et al. Acinetobacter baumannii: evolution of antimicrobial resistance-treatment options. Semin Respir Crit Care Med. 2015 Feb;36(1):85-98
5. McCarthy K. Pseudomonas aeruginosa: evolution of antimicrobial resistance and implications for therapy. Semin Respir Crit Care Med. 2015 Feb;36(1):44-55
6. Russotto V et al. Bloodstream infections in intensive care unit patients: distribution and antibiotic resistance of bacteria. Infect Drug Resist. 2015 Aug 10;8:287-96
7. Davis JS et al. Combination Antibiotic Treatment of Serious Methicillin-Resistant Staphylococcus aureus Infections. Semin Respir Crit Care Med 2015; 36(01): 003-016
8. European Center fo Disease Prevention and Control. Antimicrobial resistance interactive database (EARS-Net). Nov. 2015
9. Palomar M et al. Impact of a national multimodal intervention to prevent catheter-related bloodstream infection in the ICU: the Spanish experience. Crit Care Med. 2013 Oct;41(10):2364-72
10. Álvarez Lerma F et al. Guidelines for the prevention of ventilator-associated pneumonia and their implementation. The Spanish «Zero-VAP» bundle. Med Intensiva. 2014 May;38(4):226-36
11. Montero JG et al. Combatting resistance in intensive care: the multimodal approach of the Spanish ICU „Zero Resistance” program. Crit Care. 2015 Mar 16;19:114
12. Vazquez-Grande G, Kumar A. Optimizing antimicrobial therapy of sepsis and septic shock: focus on antibiotic combination therapy. Semin Respir Crit Care Med. 2015 Feb;36(1):154-66
13. Kumar A et al. Initiation of inappropriate antimicrobial therapy results in a fivefold reduction of survival in human septic shock. Chest. 2009 Nov;136(5):1237-48
14. Luyt CE et al. Antibiotic stewardship in the intensive care unit. Crit Care. 2014 Aug 13;18(5):480
15. Abdul-Aziz MH et al. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Semin Respir Crit Care Med. 2015 Feb;36(1):136-53
16. Micek ST et al. A randomized controlled trial of an antibiotic discontinuation policy for clinically suspected ventilator-associated pneumonia. Chest. 2004 May;125(5):1791-9
17. Chastre J et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial. JAMA. 2003 Nov 19;290(19):2588-98
18. Drusano GL. Pharmacokinetics and pharmacodynamics of antimicrobials. Clin Infect Dis. 2007 Jul 15;45 Suppl 1:S89-95
19. Moore RD et al. Clinical response to aminoglycoside therapy: importance of the ratio of peak concentration to minimal inhibitory concentration. J Infect Dis. 1987 Jan;155(1):93-9
20. McKinnon PS et al. Evaluation of area under the inhibitory curve (AUIC) and time above the minimum inhibitory concentration (T>MIC) as predictors of outcome for cefepime and ceftazidime in serious bacterial infections. Int J Antimicrob Agents. 2008 Apr;31(4):345-51
21. Craig WA. Basic pharmacodynamics of antibacterials with clinical applications to the use of beta lactams, glycopeptides, and linezolid. Infect Dis Clin North Am. 2003 Sep;17(3):479-501
22. Moise-Broder PA et al. Pharmacodynamics of vancomycin and other antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections. Clin. Pharmacokinet. 43: 925–942
23. Baquero F, Negri MC. Strategies to minimize the development of antibiotic resistance. J Chemother. 1997 May;9 Suppl 3:29-37
24. Carlier M et al. Optimizing β-Lactam Antibiotic Therapy in the Critically Ill: Moving Towards Patient-tailored Antibiotic Therapy. Annual Update in Intensive Care and Emergency Medicine 2013. Springer International 2013:111-123
25. Livermore DM et al. Chequerboard titration of cephalosporin CXA-101 (FR264205) and tazobactam versus beta lactamase-producing Enterobacteriaceae. J Antimicrob Chemother. 2010 Sep;65(9):1972-4
26. Zhanel GG et al. Ceftazidime-avibactam: a novel cephalosporin/β-lactamase inhibitor combination. Drugs. 2013 Feb;73(2):159-77
27. Riccobene TA et al. Single- and multiple-dose study to determine the safety, tolerability, and pharmacokinetics of ceftaroline fosamil in combination with avibactam in healthy subjects. Antimicrob Agents Chemother. 2013 Mar;57(3):1496-504
28. Walkty A et al. In vitro activity of plazomicin against 5,015 gram-negative and gram-positive clinical isolates obtained from patients in canadian hospitals as part of the CANWARD study, 2011-2012. Antimicrob Agents Chemother. 2014 May;58(5):2554-63
29. Urbina O et al. Potential role of tedizolid phosphate in the treatment of acute bacterial skin infections. Drug Des Devel Ther. 2013 Apr 3;7:243-65
30. Locher HH et al. Investigations of the mode of action and resistance development of cadazolid, a new antibiotic for treatment of Clostridium difficile infections. Antimicrob Agents Chemother. 2014;58(2):901-8
31. Locher HH et al. In vitro and in vivo antibacterial evaluation of cadazolid, a new antibiotic for treatment of Clostridium difficile infections. Antimicrob Agents Chemother. 2014;58(2):892-900
32. Barriere, SL. The ATTAIN trials: efficacy and safety of telavancin compared with vancomycin for the treatment of hospital-acquired and ventilator-associated bacterial pneumonia. Future Microbiol. 2014;9:281–289
33. Corey GR et al. Single-dose oritavancin in the treatment of acute bacterial skin infections. N Engl J Med. 2014 Jun 5;370(23):2180-90
34. Boucher HW et al. Once-weekly dalbavancin versus daily conventional therapy for skin infection. N Engl J Med. 2014 Jun 5;370(23):2169-79
35. Sutcliffe JA et al. Antibacterial activity of eravacycline (TP-434), a novel fluorocycline, against hospital and community pathogens. Antimicrob Agents Chemother. 2013 Nov;57(11):5548-58
36. Solomkin JS et al. Phase 2, randomized, double-blind study of the efficacy and safety of two dose regimens of eravacycline versus ertapenem for adult community-acquired complicated intra-abdominal infections. Antimicrob Agents Chemother. 2014;58(4):1847-54
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe