
Anul 2022 a făcut posibilă consolidarea unor rezultate deja anunţate în peisajul terapeutic al cancerului de sân.
Tratamentul stadiilor incipiente ale cancerului de sân a înregistrat în anul precedent trei molecule: abemaciclib, olaparib și pembrolizumab, la baza acestor decizii stând datele trialurilor clinice monarchE, OlympiA, KEYNOTE-255. În plus, s-a produs o importantă schimbare de viziune legată de clasificarea cancerelor mamare, introducând o entitate nouă – cancerele mamare cu expresie scăzută HER2 (HER2-low).
Două schimbări majore au marcat anul 2022 în legătură cu aceste subtipuri de cancer mamar: introducerea în tratamentul adjuvant al cancerelor cu risc crescut a unui inhibitor de cyclin-dependent kinază 4/6 – abemaciclib – și confirmarea eficienţei crescute a inhibitorilor de aromatază faţă de tamoxifen în tratamentul adjuvant al pacientelor în premenopauză.
a. Abemaciclib (monarchE)
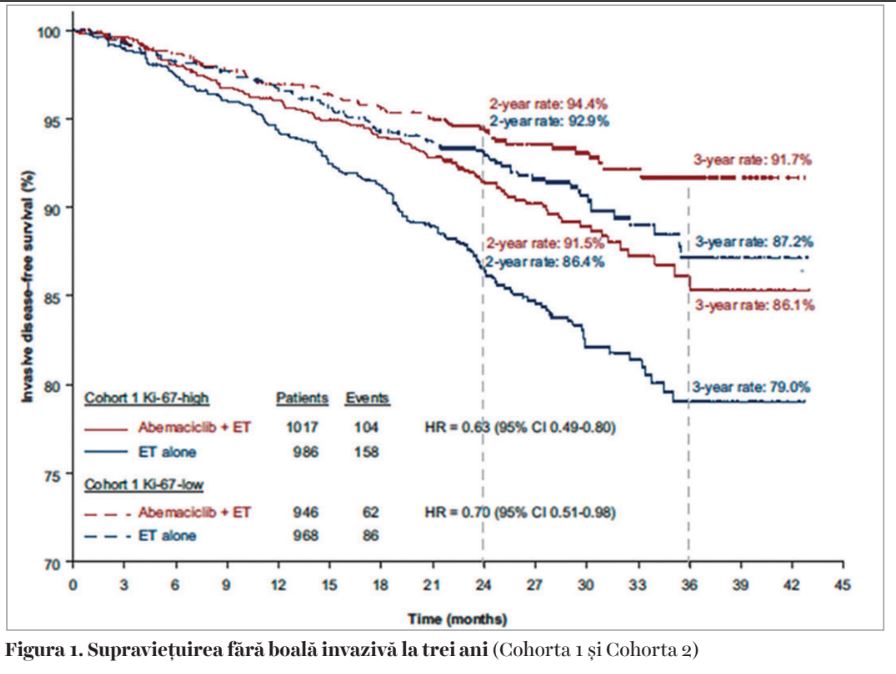
Studiul clinic monarchE a înrolat 5.637 de pacienţi cu cancer mamar incipient, HR+/HER2, cu risc înalt, definit ca ≥4 ganglioni invadaţi sau 1-3 ganglioni pozitivi și cel puţin încă unul dintre factorii de risc următori: T ≥5 cm, G3 (Cohorta 1) sau Ki67 ≥20% (Cohorta 2), pe care i-a randomizat, după încheierea chirurgiei, chimioterapiei și/sau a radioterapiei pentru a primi hormonoterapie adjuvantă la alegerea investigatorului versus hormonoterapie și abemaciclib 150 mg x 2/zi, timp de 2 ani. Obiectivul primar al studiului a fost evaluarea supravieţuirii fără boală invazivă, iar obiectivele secundare au fost evaluarea supravieţuirii fără recidivă la distanţă, supravieţuirea generală și siguranţa medicamentului.
Primele raportări (1) au fost făcute la 19 luni de urmărire și au arătat o scădere a riscului de recidivă invazivă de 25% în favoarea braţului cu abemaciclib: HR 0,75 (95% CI 0,60-0,93, P=0,01). Analiza ulterioară (2) s-a făcut după o urmărire mediană de 27 de luni, când 90% dintre pacienţi opriseră tratamentul. Diferenţa dintre cele două braţe a crescut: HR 0,70 (95% CI 0,59-0,82, P<0,0001) (Figura 1). Au fost raportate și datele referitoare la supravieţuirea fără recidivă la distanţă, care au arătat o scădere a riscului de metastazare cu 31% pentru pacienţii care au primit tratament cu abemaciclib: HR 0,69 (95% CI 0,57-0,83, P<0,0001). La trei ani, beneficiul absolut pentru supravieţuirea fără recidivă este de 5,4%, iar pentru supravieţuirea fără metastazare de 4,2%.
În plus, trialul monarchE nu a identificat date noi privind siguranţa abemaciclibului, cel mai frecvent întâlnite evenimente adverse fiind diareea, neutropenia și fatigabilitatea. De menţionat că numai 6,5% dintre pacienţii din braţul cu abemaciclib au întrerupt tratamentul din cauza evenimentelor adverse.
Studiul a mai avut un obiectiv stabilit, și anume, evaluarea Ki67 ca factor prognostic și predictiv (Tabel). Valoarea prognostică a fost confirmată, pacienţii cu valori <20% ale factorului de proliferare având supravieţuiri mai bune decât cei cu valori peste 20%, indiferent de braţul de tratament. Ki67 nu s-a dovedit a fi un factor predictiv, deoarece ambele cohorte au beneficiat de adăugarea abemaciclibului.
b. Inhibitori de aromatază în premenopauză
Ghidurile actuale recomandă utilizarea inhibitorilor de aromatază în tratamentul adjuvant al pacientelor în postmenopauză, bazându-se pe rezultatele studiilor BIG 1-98 (3), ATAC (4) și TEAM (5). Acestea au dovedit o scădere a riscului de recidivă cu aproximativ 30%, faţă de tamoxifen. Confirmarea beneficiului privind supravieţuirea fără recidivă și a supravieţuirii generale a venit de la metaanaliza Early Breast Cancer Trialists’ Collaborative Group (EBCTCG) (6). Pentru pacientele în premenopauză, tamoxifenul a rămas prima opţiune de tratament hormonal adjuvant, deși date care să sugereze că inhibitorii de aromatază (cu analogi de LH-RH) sunt superiori acestuia au fost aduse de analiza combinată a studiilor SOFT și TEXT (7).
Metaanaliza EBCTCG, publicată în anul 2022 (8), a inclus 7.030 de paciente în premenopauză, care au provenit din patru studii clinice randomizate (ABCSG XII, SOFT, TEXT și HOBOE), cu o urmărire mediană de opt ani. Rata de recidivă a bolii a fost mai scăzută pentru pacientele care au primit inhibitori de aromatază (letrozol, anastrozol, exemestan) faţă de tamoxifen: RR 0,79 (95% CI 0,69-0,90, P=0,0005). Beneficiul a fost confirmat în primii patru ani de tratament hormonal, valoarea absolută la cinci ani fiind de 3,2% (95% CI 1,8-4,5).
Nu a fost dovedit, însă, același câștig pentru următorii ani de tratament hormonal (5-9 ani sau >10 ani). Suplimentar, a fost dovedit un beneficiu legat de supravieţuirea fără metastazare în favoarea inhibitorilor de aromatază RR 0,83 (95% CI 0,71-0,97, P=0,018), dar nu au existat diferenţe semnificative în ceea ce privește mortalitatea prin cancer mamar (RR 1,01) sau de orice altă cauză (RR 1,04).
c. Denosumab
ABCSG 18 (9,10) este un studiu clinic prospectiv, randomizat, care a inclus 3.425 de paciente cu cancer mamar HR+, în postmenopauză, care au primit hormonoterapie (cu inhibitori de aromatază) cu sau fără denosumab 60 mg la 6 luni.
Obiectivul primar al studiului a fost evaluarea timpului până la prima fractură osoasă. Obiectivele secundare au inclus supravieţuirea fără semne de boală, supravieţuirea fără metastaze osoase și supravieţuirea generală.
Studiul a arătat o reducere semnificativă a riscului de fractură osoasă pentru pacientele care primesc denosumab (HR: 0,76, P=0,004). Analiza actualizată (11), la opt ani de urmărire, a arătat că tratamentul adjuvant cu denosumab îmbunătăţește supravieţuirea fără boală (HR: 0,82, P=0,010), fără metastaze osoase (HR: 0,81, P=0,047) și pe cea generală (HR: 0,80, P=0,065).
Nu au apărut modificări ale abordării terapeutice ale cancerelor mamare Her2-pozitive. Singura actualizare notabilă a fost a datelor studiului clinic APHINITY (12) la 8,4 ani de urmărire. Se menține diferența în favoarea dublei blocade HER2 cu trastuzumab și pertuzumab pentru supraviețuirea fără recidivă invazivă – HR: 0,77 (95% CI 0,66-0,91); diferența la 8,4 ani a fost de 2,6% (88,4% vs. 85,8%).
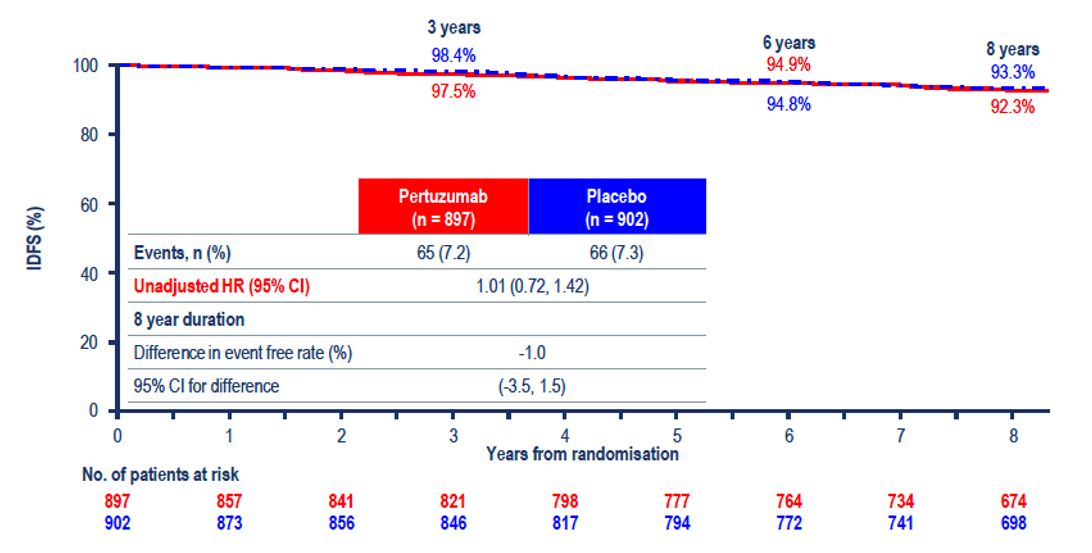
Beneficiul a fost demonstrat doar la pacienții cu ganglioni pozitivi (HR: 0,72) (Figura 2), nu și pentru cei cu ganglioni negativi (HR: 1,01) (Figura 3), care au fost la momentul analizei în proporție de >92% fără recidivă. Beneficiul nu a fost influențat de prezența sau absența expresiei receptorilor hormonali. Studiul nu a demonstrat niciun beneficiu în ce privește supraviețuirea generală HR: 0,83 (95% CI 0,68-1,02, P=0,078), ratele de supraviețuire la opt ani fiind de 92,7% vs. 92,0%.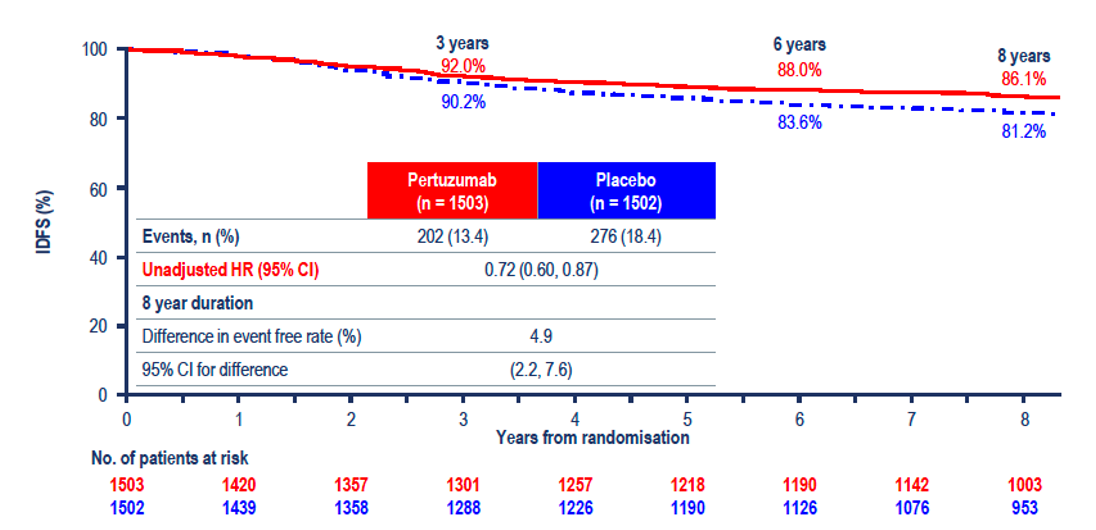
a. KEYNOTE-522
În 2022 au fost publicate datele de supravieţuire ale studiului KEYNOTE-522 (12). Trialul a randomizat 1.174 de paciente diagnosticate cu cancer mamar triplu-negativ, în stadiu incipient, pentru a primi chimioterapie neoadjuvantă (antracicline și paclitaxel cu carboplatin) cu pembrolizumab sau placebo. Obiectivul primar al studiului a fost evaluarea răspunsului patologic complet (13), care a fost îmbunătăţit semnificativ prin adăugarea imunoterapiei (64,8% vs. 51,2%, P<0,001).
Obiectivul secundar al studiului a fost evaluarea supravieţuirii fără evenimente în cele două braţe. La o urmărire mediană de trei ani, rata de supravieţuire fără recidivă a fost de 84,5% în braţul cu pembrolizumab, faţă de 76,8% în cel cu placebo (HR: 0,63, 95% CI 0,48-0,82, P<0,001) (Figura 4).
b. NeoSTAR
Sacituzumab govitecan (SG) este un conjugat medicament-anticorp înregistrat în tratamentul de linia a doua al cancerelor mamare triplu-negative. În trialul de fază II NeoSTAR (14), 50 de pacienţi cu cancer mamar triplu-negativ în stadiile I și II au primit ca tratament neoadjuvant SG, 10 mg/kgc în zilele 1 și 8 ale unui ciclu de 21 de zile, timp de 4 cicluri. Pentru pacienţii la care nu s-a obţinut răspuns patologic complet (dovedit prin biopsie), s-a putut continua tratamentul cu chimioterapie la alegerea investigatorului.
Răspuns imagistic s-a obţinut la 62% dintre pacienţi, iar rata remisiei patologice complete a fost de 30%. Cele mai frecvente evenimente secundare au fost greaţa (82%), astenia fizică (78%), alopecia (76%), neutropenia (58%), anemia (36%) și rash-ul (48%). Deși 6% dintre pacienţi au necesitat scăderea dozei, nu au fost pacienţi care să întrerupă tratamentul.
Material preluat din volumul „Terapii moderne în cancer”, editat de Viaţa Medicală în 2022.
Bibliografie
1. Johnston SRD, Harbeck N, Hegg R, Toi M, Martin M, Shao ZM, Zhang QY, Martinez Rodriguez JL, Campone M, Hamilton E, Sohn J, Guarneri V, Okada M, Boyle F, Neven P, Cortés J, Huober J, Wardley A, Tolaney SM, Cicin I, Smith IC, Frenzel M, Headley D, Wei R, San Antonio B, Hulstijn M, Cox J, O'Shaughnessy J, Rastogi P; monarchE Committee Members and Investigators. Abemaciclib Combined With Endocrine Therapy for the Adjuvant Treatment of HR+, HER2-, Node-Positive, High-Risk, Early Breast Cancer (monarchE). J Clin Oncol. 2020 Dec 1;38(34):3987-3998. doi: 10.1200/JCO.20.02514. Epub 2020 Sep 20. PMID: 32954927; PMCID: PMC7768339
2. Harbeck N, Rastogi P, Martin M, Tolaney SM, Shao ZM, Fasching PA, Huang CS, Jaliffe GG, Tryakin A, Goetz MP, Rugo HS, Senkus E, Testa L, Andersson M, Tamura K, Del Mastro L, Steger GG, Kreipe H, Hegg R, Sohn J, Guarneri V, Cortés J, Hamilton E, André V, Wei R, Barriga S, Sherwood S, Forrester T, Munoz M, Shahir A, San Antonio B, Nabinger SC, Toi M, Johnston SRD, O'Shaughnessy J; monarchE Committee Members. Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer: updated efficacy and Ki-67 analysis from the monarchE study. Ann Oncol. 2021 Dec;32(12):1571-1581. doi: 10.1016/j.annonc.2021.09.015. Epub 2021 Oct 14. PMID: 34656740
3. Regan MM, Neven P, Giobbie-Hurder A, Goldhirsch A, Ejlertsen B, Mauriac L, Forbes JF, Smith I, Láng I, Wardley A, Rabaglio M, Price KN, Gelber RD, Coates AS, Thürlimann B; BIG 1-98 Collaborative Group; International Breast Cancer Study Group (IBCSG). Assessment of letrozole and tamoxifen alone and in sequence for postmenopausal women with steroid hormone receptor-positive breast cancer: the BIG 1-98 randomised clinical trial at 8·1 years median follow-up. Lancet Oncol. 2011 Nov;12(12):1101-8. doi: 10.1016/S1470-2045(11)70270-4. Epub 2011 Oct 20. PMID: 22018631; PMCID: PMC3235950
4. Baum M, Buzdar A, Cuzick J, Forbes J, Houghton J, Howell A, Sahmoud T; ATAC (Arimidex, Tamoxifen Alone or in Combination) Trialists' Group. Anastrozole alone or in combination with tamoxifen versus tamoxifen alone for adjuvant treatment of postmenopausal women with early-stage breast cancer: results of the ATAC (Arimidex, Tamoxifen Alone or in Combination) trial efficacy and safety update analyses. Cancer. 2003 Nov 1;98(9):1802-10. doi: 10.1002/cncr.11745. PMID: 14584060
5. van de Velde CJ, Rea D, Seynaeve C, Putter H, Hasenburg A, Vannetzel JM, Paridaens R, Markopoulos C, Hozumi Y, Hille ET, Kieback DG, Asmar L, Smeets J, Nortier JW, Hadji P, Bartlett JM, Jones SE. Adjuvant tamoxifen and exemestane in early breast cancer (TEAM): a randomised phase 3 trial. Lancet. 2011 Jan 22;377(9762):321-31. doi: 10.1016/S0140-6736(10)62312-4. PMID: 21247627
6. Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet. 2015 Oct 3;386(10001):1341-1352. doi: 10.1016/S0140-6736(15)61074-1. Epub 2015 Jul 23. PMID: 26211827
7. Pagani O, Francis PA, Fleming GF, Walley BA, Viale G, Colleoni M, Láng I, Gómez HL, Tondini C, Pinotti G, Di Leo A, Coates AS, Goldhirsch A, Gelber RD, Regan MM; SOFT and TEXT Investigators and International Breast Cancer Study Group. Absolute Improvements in Freedom From Distant Recurrence to Tailor Adjuvant Endocrine Therapies for Premenopausal Women: Results From TEXT and SOFT. J Clin Oncol. 2020 Apr 20;38(12):1293-1303. doi: 10.1200/JCO.18.01967. Epub 2019 Oct 16. PMID: 31618131; PMCID: PMC7164485
8. Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Aromatase inhibitors versus tamoxifen in premenopausal women with oestrogen receptor-positive early-stage breast cancer treated with ovarian suppression: a patient-level meta-analysis of 7030 women from four randomised trials. Lancet Oncol. 2022 Mar;23(3):382-392. doi: 10.1016/S1470-2045(21)00758-0. Epub 2022 Feb 3. Erratum in: Lancet Oncol. 2022 Apr;23(4):e161. PMID: 35123662; PMCID: PMC8885431
9. Gnant M, Pfeiler G, Steger GG, et al. Adjuvant denosumab in postmenopausal patients with hormone receptor-positive breast cancer (ABCSG-18): disease-free survival results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2019;20(3):339-351
10. Gnant M, Pfeiler G, Dubsky PC, et al. Adjuvant denosumab in breast cancer (ABCSG-18): a multicentre, randomised, double-blind, placebo-controlled trial. Lancet. 2015;386(9992):433-443
11. Michael Gnant, Sophie Frantal, Georg Pfeiler, Guenther G. Steger, Daniel Egle, Richard Greil, Florian Fitzal, Viktor Wette, Marija Balic, Ferdinand Haslbauer, Elisabeth Melbinger-Zeinitzer, Vesna Bjelic-Radisic, Christine Brunner, Silvia Artner-Matuschek, Gabriel Rinnerthaler, Kerstin Wimmer, Jonas C. S. Bergh, Christian Fesl, and Christian F. Singer - Long-term outcomes of adjuvant denosumab in breast cancer: Fracture reduction and survival results from 3,425 patients in the randomised, double-blind, placebo-controlled ABCSG-18 trial. Journal of Clinical Oncology 2022 40:16_suppl, 507-507
12. S. Loibl; J. Jassem; A. Sonnenblick; G. Viale; J. Bines; M. Piccart - Adjuvant pertuzumab and trastuzumab in patients with early HER-2 positive breast cancer in APHINITY: 8.4 years' follow-up, https://doi.org/10.1016/j.annonc.2022.06.009
13. Schmid P, Cortes J, Dent R, Pusztai L, McArthur H, Kümmel S, Bergh J, Denkert C, Park YH, Hui R, Harbeck N, Takahashi M, Untch M, Fasching PA, Cardoso F, Andersen J, Patt D, Danso M, Ferreira M, Mouret-Reynier MA, Im SA, Ahn JH, Gion M, Baron-Hay S, Boileau JF, Ding Y, Tryfonidis K, Aktan G, Karantza V, O'Shaughnessy J; KEYNOTE-522 Investigators. Event-free Survival with Pembrolizumab in Early Triple-Negative Breast Cancer. N Engl J Med. 2022 Feb 10;386(6):556-567. doi: 10.1056/NEJMoa2112651. PMID: 35139274
14. Schmid P, Cortes J, Pusztai L, McArthur H, Kümmel S, Bergh J, Denkert C, Park YH, Hui R, Harbeck N, Takahashi M, Foukakis T, Fasching PA, Cardoso F, Untch M, Jia L, Karantza V, Zhao J, Aktan G, Dent R, O'Shaughnessy J; KEYNOTE-522 Investigators. Pembrolizumab for Early Triple-Negative Breast Cancer. N Engl J Med. 2020 Feb 27;382(9):810-821. doi: 10.1056/NEJMoa1910549. PMID: 32101663
15. Laura Spring, Sara M. Tolaney, Neelam Vijay Desai, Geoffrey Fell, Lorenzo Trippa, Amy H. Comander, Therese Marie Mulvey, Shannon McLaughlin, Phoebe Ryan, Aron S. Rosenstock, Ana Christina Garrido-Castro, Filipa Lynce, Beverly Moy, Steven J. Isakoff, Nadine M. Tung, Elizabeth A. Mittendorf, Leif W. Ellisen, and Aditya Bardia - Phase 2 study of response-guided neoadjuvant sacituzumab govitecan (IMMU-132) in patients with localized triple-negative breast cancer: Results from the NeoSTAR trial. Journal of Clinical Oncology 2022 40:16_suppl, 512-512
16. Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, Paluch-Shimon S, Campone M, Petrakova K, Blackwell KL, Winer EP, Janni W, Verma S, Conte P, Arteaga CL, Cameron DA, Mondal S, Su F, Miller M, Elmeliegy M, Germa C, O'Shaughnessy J. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol. 2018 Jul 1;29(7):1541-1547. doi: 10.1093/annonc/mdy155. Erratum in: Ann Oncol. 2019 Nov 1;30(11):1842. PMID: 29718092
17. Rugo, H. S., et al. (2022). "Primary results from TROPiCS-02: A randomized phase 3 study of Sacituzumab Govitecan (SG) versus treatment of physician’s choice (TPC) in patients (Pts) with hormone receptor–positive/ HER2-negative (HR+/HER2-) advanced breast cancer." Journal of Clinical Oncology 40(17_suppl) LBA1001 LBA1001
18. Modi S, Jacot W, Yamashita T, Sohn J, Vidal M, Tokunaga E, Tsurutani J, Ueno NT, Prat A, Chae YS, Lee KS, Niikura N, Park YH, Xu B, Wang X, Gil-Gil M, Li W, Pierga JY, Im SA, Moore HCF, Rugo HS, Yerushalmi R, Zagouri F, Gombos A, Kim SB, Liu Q, Luo T, Saura C, Schmid P, Sun T, Gambhire D, Yung L, Wang Y, Singh J, Vitazka P, Meinhardt G, Harbeck N, Cameron DA; DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20. doi: 10.1056/NEJMoa2203690. Epub 2022 Jun 5. PMID: 35665782
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe