În alegerea terapiei avansate se recomandă selectarea pacienţilor, pentru a ţine cont de aspecte legate de siguranţa și eficacitatea fiecărei modalităţi de tratament.
După ani de tratament al bolii Parkinson (BP), terapia dopaminergică standard își pierde eficienţa. Iar strategiile precum scurtarea intervalelor între dozele de levodopa, introducerea unui agonist dopaminergic cu durată lungă de acţiune sau adăugarea unui medicament ce reduce metabolismul levodopa nu mai reușesc să diminueze fluctuaţiile motorii. În această etapă, ar trebui luat în calcul managementul avansat al bolii Parkinson. Tratamentele disponibile în prezent pentru boala Parkinson avansată (BPA) sunt: terapiile prin infuzie, stimularea cerebrală profundă, terapiile ablative și terapia genică. Toate aceste tratamente sunt simptomatice, neavând impact asupra progresiei neurodegenerescenţei subiacente. Ele pot prelungi efectul maxim al levodopa.
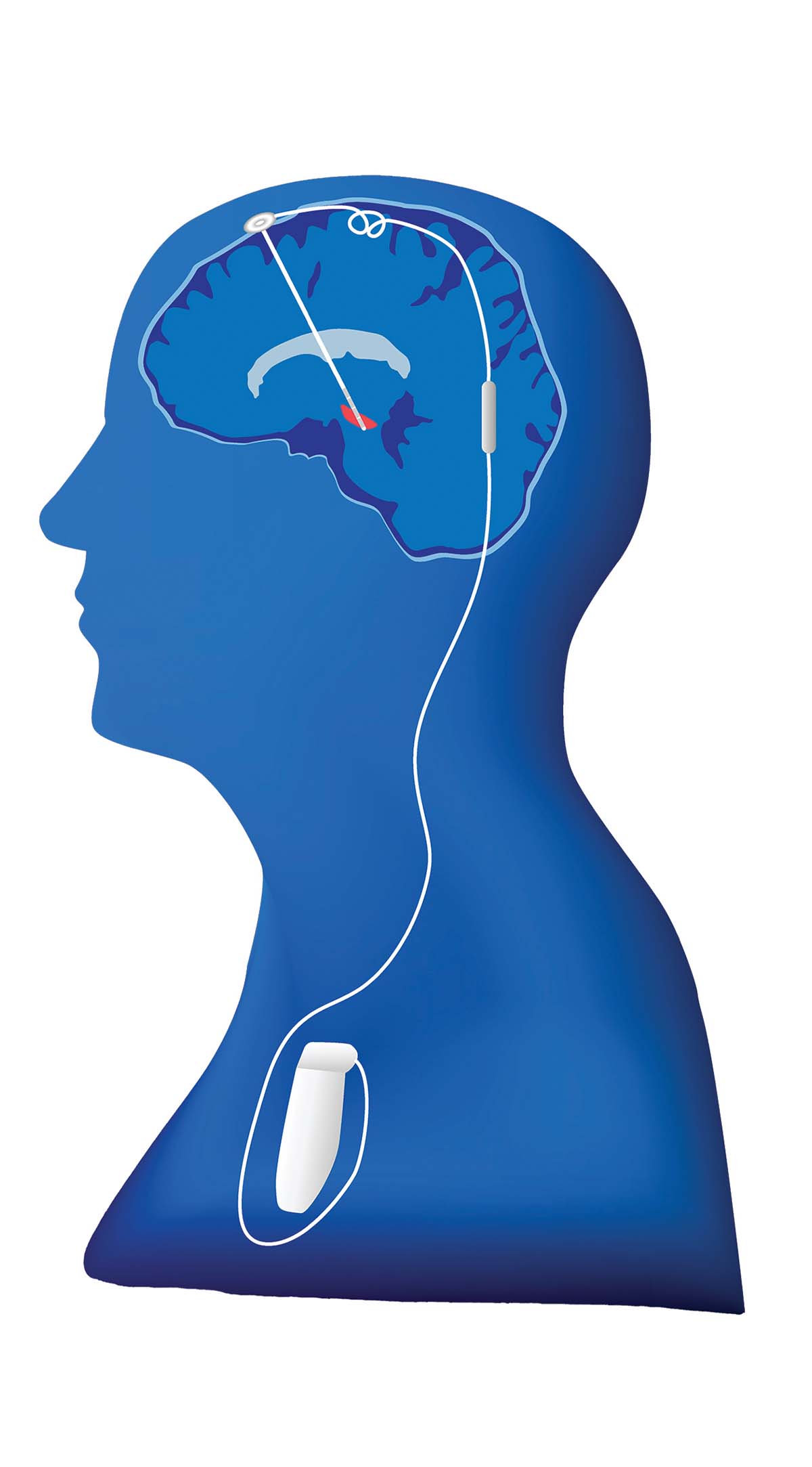
Stimularea cerebrală profundă (deep brain stimulation, DBS) este disponibilă de 25 de ani, cu eficacitate stabilită prin mai multe studii clinice randomizate. Pentru DBS, doi electrozi sunt plasaţi bilateral, la nivelul subtalamusului sau al globus pallidus intern. Studii randomizate au demonstrat îmbunătăţiri ale simptomatologiei în urma terapiei cu DBS comparativ cu cel mai bun tratament farmacologic. La șase luni postoperator, simptomele motorii și calitatea vieţii în grupul pacienţilor cu DBS s-au îmbunătăţit cu 20% faţă de momentul iniţial, cu menţinerea pe termen lung a acestui efect, în timp ce grupul cu tratament farmacologic nu a prezentat îmbunătăţire clinică (1).
Efectele adverse ale DBS pot fi separate în trei categorii: legate de intervenţia chirurgicală (infecţia și hemoragiile), legate de dispozitiv (ruperea, migrarea și funcţionarea defectuoasă a electrodului) și cele legate de stimulare, care apar din cauza propagării curentului electric în arii nedorite, dar care pot fi mediate prin ajustări ale parametrilor dispozitivului (2).
Deși există multe avantaje ale acestei terapii, trebuie avute în vedere considerente etice și specifice fiecărui pacient. DBS este o intervenţie chirurgicală minim invazivă, cu incidenţă scăzută a infecţiilor și a hemoragiilor simptomatice, însă care are costuri ridicate și necesită o echipă multidisciplinară de experţi pentru managementul pacientului. Candidaţii ideali pentru DBS sunt cei cu fluctuaţii motorii și/sau cu boală Parkinson avansată, fără alte „red flags” pentru un diagnostic alternativ. Pacienţii cu probleme psihiatrice sau comorbidităţi multiple nu sunt în general candidaţi pentru această terapie (2).
DBS se utilizează și în România, dar pentru un număr foarte mic de pacienţi, din cauza costurilor ridicate ale intervenţiei.
Terapiile ablative pentru tulburările neurologice au ca scop distrugerea unui volum ţintit de ţesut cerebral. Există trei terapii ablative utilizate în tratamentul BP: ablaţia prin radiofrecvenţă, radiochirurgia stereotactică și ablaţia cu ultrasunete.
Ablaţia prin radiofrecvenţă constă în crearea unei leziuni prin încălzirea unui electrod plasat intracranian. În timpul procedurii, pacienţii sunt vigili, pentru a se putea evalua intraoperator ameliorarea simptomelor prin stimularea ţintei. Ablaţia prin radiofrecvenţă reprezintă un tratament eficient, dar efectele sale sunt ireversibile. Dezavantajele includ predictibilitatea scăzută în ceea ce privește dimensiunea și forma leziunii. În timp ce efectele adverse sunt, în general, ușoare și tranzitorii, trebuie luat în considerare riscul chirurgical de hemoragie intracerebrală. Deși se utilizează mai rar în ţările cu venituri ridicate, ablaţia prin radiofrecvenţă rămâne o strategie de tratament rezonabilă în ţările cu resurse limitate (3).
Radiochirurgia stereotactică (stereotactic radiosurgery, SRS) este o procedură neinvazivă prin care se administrează o singură doză de radiaţie ionizantă pe o zonă de interes. Un beneficiu major al SRS este că permite un tratament intracranian precis fără deschiderea craniului, eliminând riscul chirurgical de hemoragie și infecţii. Un dezavantaj major al SRS pentru tratarea tulburărilor de mișcare este că există adesea întârzieri semnificative în ameliorarea simptomelor (trei-șase luni). Efectul întârziat, expunerea la radiaţii ionizante și lipsa de feedback intraoperator sunt dezavantaje care trebuie luate în considerare atunci când se utilizează SRS ca tratament pentru BP avansată. Totuși, SRS rămâne o opţiune bună pentru pacienţii cu comorbidităţi semnificative care nu pot fi supuși unor proceduri invazive (4).
În ablaţia cu ultrasunete sub ghidaj IRM (imagistică prin rezonanţă magnetică), regiunea de interes este ţintită printr-o procedură de focalizare cu ultrasunete de intensitate ridicată. Ablaţia structurii-ţintă se realizează prin intermediul energiei mecanice a ultrasunetelor, care este absorbită focalizat în interiorul zonei-ţintă și transformată în căldură. Monitorizarea în timp real a direcţionării precise a ţintelor este posibilă prin ghidaj IRM. Aceasta permite ablaţia precisă a structurilor cerebrale profunde, eliminând în același timp necesitatea unei craniotomii. Avantajul acestei proceduri este că pacientul poate fi examinat după fiecare administrare de ultrasunete. Astfel, se efectuează o serie de teste cu ultrasunete low-level, ce generează temperaturi scăzute, rezultând beneficii tranzitorii și efecte adverse minime. După verificarea clinică a efectului intervenţiei cu temperaturi scăzute, temperatura va fi crescută, rezultând o leziune permanentă. Ablaţia cu ultrasunete a nucleului ventral-intermediar al talamusului este aprobată în prezent pentru tratamentul tremorului. Alte ţinte sunt în curs de studiu sau de aprobare (5).
Ablaţia cu ultrasunete poate fi o opţiune pentru pacienţii cu BP avansată care nu sunt candidaţi pentru tehnici mai invazive. Ca și în cazul celorlalte terapii ablative, natura ireversibilă a procedurii trebuie luată în considerare. Cu toate acestea, în timpul tratamentului, pacienţii sunt evaluaţi clinic pentru ameliorarea simptomelor și apariţia efectelor adverse, iar tratamentul poate fi ajustat după cum este necesar (2).
Terapia de suplinire genică pentru BP constă în utilizarea unui vector viral pentru a furniza secvenţe de ADN care codifică genele implicate în patogeneza bolii. Terapiile genice au ca scop fie creșterea biodisponibilităţii dopaminei în calea nigrostriatală, fie promovarea funcţionării optime a neuronilor dopaminergici prin menţinerea și restabilirea factorilor neurotrofici. Putamenul este regiunea cerebrală cea mai afectată de denervarea dopaminergică în BP, astfel că terapiile genice au ca scop restabilirea dopaminei în putamen. Mai multe studii de terapie genică s-au concentrat pe creșterea expresiei enzimelor implicate în sinteza dopaminei: tirozin hidroxilaza (TH), L-aminoacid decarboxilaza (AADC) și GTP-ciclohidroxilaza (CGH1) (2).
Iniţierea terapiilor pentru BP avansată este adesea luată în considerare atunci când medicamentele orale nu reușesc să controleze în mod adecvat simptomele motorii ale pacientului. Opţiunile terapeutice pentru BPA evoluează rapid, dar încă lipsesc studii care să compare eficacitatea și siguranţa lor. Astfel, în selectarea terapiei avansate, se recomandă o abordare specifică pacienţilor, care ar trebui să ţină cont de aspecte legate de siguranţa și eficacitatea fiecărei modalităţi de tratament.
Citește și Boala Parkinson avansată și terapiile prin infuzie
Definiţia BPA rămâne controversată și se bazează în mare măsură pe opinia comună între experţi. Aceasta se referă la acel moment din cursul evoluţiei bolii în care fluctuaţiile motorii, non-motorii și diskineziile au un impact sever asupra calităţii vieţii pacientului și asupra poverii îngrijitorilor acestuia (6).
Pe măsură ce speranţa de viaţă crește și populaţia îmbătrânește, numărul persoanelor cu boală Parkinson, precum și durata acestei boli vor continua și ele să crească.
Bibliografie
1. Rocca WA. The burden of Parkinson's disease: a worldwide perspective. Lancet Neurol. 2018;17(11):928-929. doi:10.1016/S1474-4422(18)30355-7
2. GBD 2016 Neurology Collaborators. Global, regional, and national burden of neurological disorders, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol. 2019;18(5):459-480. doi:10.1016/S1474-4422(18)30499-X
3. Anderson DW, Rocca WA, de Rijk MC, et al. Case ascertainment uncertainties in prevalence surveys of Parkinson's disease. Mov Disord. 1998;13(4):626-632. doi:10.1002/mds.870130403
4. Stefani A, Tessitore A, Tambasco N, et al. Criteria for identification of advanced Parkinson's disease: the results of the Italian subgroup of OBSERVE-PD observational study. BMC Neurol. 2022;22(1):41. Published 2022 Jan 28. doi:10.1186/s12883-022-02554-z
5. Gilbert R, Khemani P. Treatment of Advanced Parkinson's Disease. J Geriatr Psychiatry Neurol. 2022;35(1):12-23. doi:10.1177/0891988720988904
6. Malaty IA, Martinez-Martin P, Chaudhuri KR, et al. Does the 5-2-1 criteria identify patients with advanced Parkinson's disease? Real-world screening accuracy and burden of 5-2-1-positive patients in 7 countries. BMC Neurol. 2022;22(1):35. Published 2022 Jan 24. doi:10.1186/s12883-022-02560-1
7. Dijk JM, Espay AJ, Katzenschlager R, de Bie RMA. The Choice Between Advanced Therapies for Parkinson's Disease Patients: Why, What, and When?. J Parkinsons Dis. 2020;10(s1):S65-S73. doi:10.3233/JPD-202104
8. Serva SN, Bernstein J, Thompson JA, Kern DS, Ojemann SG. An update on advanced therapies for Parkinson's disease: From gene therapy to neuromodulation. Front Surg. 2022;9:863921. Published 2022 Sep 23. doi:10.3389/fsurg.2022.863921
9. Eric C. Meyers, Bleyda R. Solorzano, Justin James, Patrick D. Ganzer, Elaine S., Robert L. Rennaker, Michael P. Kilgard and Seth Hays. Physiol Behav. 2018;176(1):100–106.
10. Sesar Á, Fernández-Pajarín G, Ares B, Rivas MT, Castro A. Continuous subcutaneous apomorphine infusion in advanced Parkinson’s disease: 10-year experience with 230 patients. J Neurol. 2017;264(5):946–54.
11. Deuschl G, Schade-Brittinger C, Krack P, Volkmann J, Schäfer H, Bötzel K, et al. A Randomized Trial of Deep-Brain Stimulation for Parkinson’s Disease. New England Journal of Medicine. 2006;355(9):896–908.
12. Franzini A, Moosa S, Servello D, Small I, DiMeco F, Xu Z, et al. Ablative brain surgery: an overview. International Journal of Hyperthermia 2019;36(2):64–80. https://doi.org/10.1080/02656736.2019.1616833
13. Ohye C, Higuchi Y, Shibazaki T, Hashimoto T, Koyama T, Hirai T, et al. Gamma knife thalamotomy for Parkinson disease and essential tremor: A prospective multicenter study. Clin Neurosurg. 2012;70(3):526–35.
14. Martínez-Fernández R, Pineda-Pardo JA. Magnetic resonance-guided focused ultrasound for movement disorders: clinical and neuroimaging advances. Curr Opin Neurol. 2020;33(4):488-497. doi:10.1097/WCO.0000000000000840
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe